
【题目】下列说法正确的是
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
科目:高中化学 来源: 题型:
【题目】利用催化技术可将汽车尾气中的NO和CO转变成![]() 和
和![]() ,化学方程式如下:
,化学方程式如下:![]() 某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:下列说法中,不正确的是
某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:下列说法中,不正确的是
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A.2s内的平均反应速率![]()
B.在该温度下,反应的平衡常数![]()
C.若将NO和CO的起始投料量均加倍,则平衡时NO转化率小于![]()
D.使用催化剂可以提高单位时间CO和NO的处理量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠用于制造陶瓷电容器的基体、颜料和催化剂。工业上以锡碲渣(主要含Na2SnO3和Na2TeO3)为原料,制备锡酸钠的工艺流程图如下,请回答下列问题:
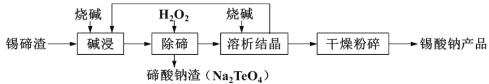
已知:锡酸钠(Na2SnO3)和亚碲酸钠(Na2TeO3)均易溶于碱。
(1)“碱浸”过程中,锡碲浸出率与溶液中游离碱质量浓度关系如图所示,则最理想的质量浓度为__________,理由是______________。

(2)如图反映的是“除碲”过程中反应温度对碲脱除率的影响关系,70℃后随温度升高碲脱除率下降的原因可能是______________。

(3)“除碲”反应的离子方程式为_________________。
(4)从“溶析结晶”回到“碱浸”的物质除烧碱外,主要还有_____________(写化学式)。
(5)“溶析结晶”母液中还含有少量SbO43-,可用锡片将Sb置换出来,锡转化成最高价含氧酸盐,写出反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是( )
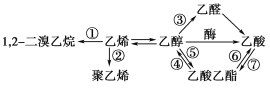
A. 只有反应③是氧化反应B. 反应①是消去反应
C. 只有反应②是加成聚合反应D. 反应④⑤⑥⑦是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据2CrO42﹣+2H+ ![]() Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的_________极,电解制备过程的总反应方程式为_________。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为_________。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为________________。
Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的_________极,电解制备过程的总反应方程式为_________。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为_________。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(VI)是主要污染物,可采用多种方法处理将其除去,查阅资料可知: 常温下,部分阳离子以氢氧化物形式沉淀时溶液的 pH 如下表:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的 pH | 1.9 | 7.0 | 4.3 |
沉淀完全的 pH | 3.2 | 9.0 | 5.6 |
I.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原 Cr(VI)。下列关于铁屑的说法中正确的是______________(填字母序号)。
a.作原电池的正极 b.在反应中作还原剂 c.铁屑生成 Fe3+可以进一步还原![]()
II.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。装置如下图所示。

(2)B极连接电源的___________极;
(3)电解开始时,B 极上主要发生的电极反应为2H++2e-= H2↑,此外还有少量![]() 在B极上直接放电,该反应的电极反应式为 _______________。
在B极上直接放电,该反应的电极反应式为 _______________。
(4)①酸性环境可以促使![]() 到
到![]() 的转化,写出对应的离子方程式:__________________;
的转化,写出对应的离子方程式:__________________;
②写出酸性环境中 Fe2+还原![]() 的离子方程式_______________________。
的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒(V)及其化合物有着广泛的用途。请回答下列问题:
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O74-中V元素的化合价是________,溶液中VO3-转化为V2O74-的离子方程式为________。

(2)偏钒酸铵是最普通的钒酸盐,将V2O5溶于碳酸钠溶液中(有气体生成),然后加入氯化铵,便可析出偏钒酸铵(NH4VO3),该过程总反应的化学方程式为________;当pH超过8.0时偏钒酸铵会发生转化,其原因是溶液中的VO3-转化为V2O74-、________(请另写出一点原因)。
(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g)![]() 2SO3(g)ΔH=pkJ/mol反应的催化剂,其催化原理如图2所示。
2SO3(g)ΔH=pkJ/mol反应的催化剂,其催化原理如图2所示。

①过程a和过程b的热化学方程式为
V2O5(s)+SO2(g)=V2O4(s)+SO3(g) ΔH=qkJ/mol
V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) ΔH=rkJ/mol
则过程c的热化学方程式为_________。
②T℃时反应2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图3所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa。则T℃时B点的化学平衡常数Kc=_________。
2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图3所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa。则T℃时B点的化学平衡常数Kc=_________。

(4)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图4所示。
①充电过程中,右槽溶液颜色逐渐由________色变为________色;
②充电时若转移的电子数为NA个,则左槽溶液中n(H+)的变化量为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以[Zn(NH3)4]2+、[Cu(NH3)4]2+、[Cd(NH3)4]2+、[AsCl5]2-的形式存在。
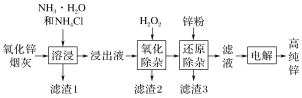
“氧化除杂”中,[AsCl5]2-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性,该反应的离子方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2O(l)=H2(g)+ ![]() O2(g) △H=+285.8 kJ/mol
O2(g) △H=+285.8 kJ/mol
②H2(g)+ ![]() O2(g)=H2O(g) △H=-241.8 kJ/mol
O2(g)=H2O(g) △H=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ/mol
④C(s)+ ![]() O2(g)=CO(g) △H=-110.5 kJ/mol
O2(g)=CO(g) △H=-110.5 kJ/mol
⑤C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于吸热反应的是____________________ 。
(2)C的燃烧热为____________________。
(3)燃烧10g H2生成液态水,放出的热量为______________。
(4)写出表示CO燃烧热的热化学方程式:__________________;写出制水煤气的热化学方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com