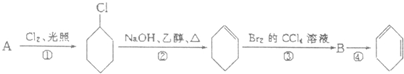
�ϳɰ��Թ�ũҵ��չ������Ҫ���壬�����Ƕ��й���Ӧ�õ��о���
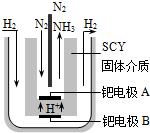
��1�����Ŷ�̨������峵ķ�չ��2001����λϣ����ѧ������˵��ϳɰ��ķ��������ڳ�ѹ�°��������ú���ϡ�͵ĵ������ֱ�ͨ��һ�����ȵ�570��ĵ����У����õ����Ե�SCY�մɣ��ܴ���H
+��Ϊ���ʣ�������������������ϵĽ����ٶྦྷ��Ĥ�ӵ缫��ʵ���˳�ѹ��570�������¸�ת���ʵĵ�ⷨ�ϳɰ���װ����ͼ���������ĵ缫��ӦʽΪ
��
��2�����Ĵ�����Ӧ�������������У�500��ʱ��NH
3��O
2���ܷ������·�Ӧ��
��4NH
3��g��+5O
2��g��?4NO��g��+6H
2O��g����H�T-9072kJ?mol
-1 K=1.1��10
26��4NH
3��g��+4O
2��g��?2N
2O��g��+6H
2O��g����H�T-1104.9kJ?mol
-1 K=4.4��10
28��4NH
3��g��+3O
2��g��?2N
2��g��+6H
2O��g����H�T-1269.02kJ?mol
-1 K=7.1��10
34д��500�棬N
2����ΪNO���Ȼ�ѧ����ʽ
��
������Ӧ�У��ڡ����Ǹ���Ӧ����Ҫ���ٸ���Ӧ�����NO�IJ��ʣ�������Ĵ�ʩ��
��
��3��ijѧϰС�������ͼװ���о��ϳɰ���Ӧ��װ����ͼ��ʾ������I�̶�����������II�������ƶ���M��N�����������������·�Ӧ��N
2��g��+3H
2��g��?2NH
3��g��

������M��N�У���ͨ��1mol N
2��3mol H
2����ʼM��N�ͻ���ͬ���������¶Ȳ��䣮��ƽ��ʱN
2��ת����a��N
2��M
a��N
2��N��M��N����ƽ���ʱ��t
M
t
N��
������ij���£���ӦN
2��g��+3H
2��g��?2NH
3��g��������N�дﵽƽ�⣬��������к���N
2 1.0mol��H
2 0.4mol��NH
3 0.4mol����ʱ�ݻ�Ϊ2.0L����������µ�ƽ�ⳣ��Ϊ
�������¶Ⱥ�ѹǿ���䣬���������ͨ��0.36mol N
2��ƽ�⽫
������������������ƶ����ü�Ҫ�ļ������˵������
��

 �ϳɰ��Թ�ũҵ��չ������Ҫ���壬�����Ƕ��й���Ӧ�õ��о���
�ϳɰ��Թ�ũҵ��չ������Ҫ���壬�����Ƕ��й���Ӧ�õ��о���



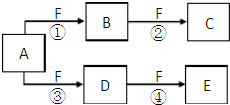 X��Y��Z�����ֶ�����Ԫ�أ�X��Z��������֮����Y����������ȣ�Z�ĵ��Ӳ�����X�ĵ��Ӳ�����2����A��B��C��D��E��F����ѧ��ѧ�еij������ʣ���������������Ԫ���е�һ�֡����ֻ�������ɣ�����A����ʹʪ���ɫʯ����ֽ���������壬D��E�������ᣬF��һ�ֵ��ʣ���Ӧ�ܾۢ������������½��У���ת����ϵ��ͼ��ʾ��
X��Y��Z�����ֶ�����Ԫ�أ�X��Z��������֮����Y����������ȣ�Z�ĵ��Ӳ�����X�ĵ��Ӳ�����2����A��B��C��D��E��F����ѧ��ѧ�еij������ʣ���������������Ԫ���е�һ�֡����ֻ�������ɣ�����A����ʹʪ���ɫʯ����ֽ���������壬D��E�������ᣬF��һ�ֵ��ʣ���Ӧ�ܾۢ������������½��У���ת����ϵ��ͼ��ʾ��