【三选一—选修2:化学与技术】
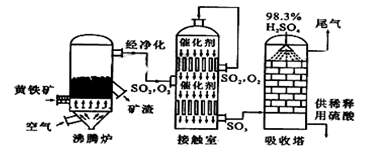
以黄铁矿为原料生产硫酸的工艺流程图如下:
(1)写出燃烧黄铁矿的化学方程式______________ 。当有6mol SO2生成时,转移电子______________mol。
(2)进入接触室的气体中含标准状态下1120m3SO2气体,达平衡后放出热量为 4.728×106kJ,此时SO2转化率为96%。该反应的热化学方程式为____________ 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)______________。
a.为使黄铁矿充分燃烧,需将其粉碎 b.过量空气能提高SO2的转化率 c.使用催化剂能提高SO2的反应速率和转化率 d.沸腾炉排出的矿渣可供炼铁 e.吸收塔用水作吸收剂 ⑷某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品充分灼烧,生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,再用0.02000 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则样品中FeS2的质量分数是多少?________(假设杂质不参加反应)
(5)该生产过程中产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是____________。(填字母)
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞

 一线名师权威作业本系列答案
一线名师权威作业本系列答案