
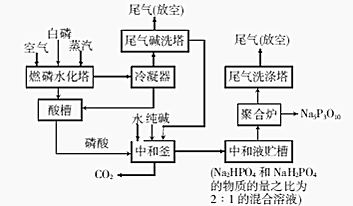
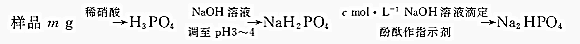
分析 白磷、空气、水蒸气进入燃磷水化塔发生反应生成磷酸进入酸槽,冷凝器中冷凝得到酸进入酸槽,尾气进入尾气碱洗塔吸收酸性气体二氧化碳生成碳酸钠循环使用,剩余尾气放空,得到磷酸进入中和釜加入纯碱和水发生反应生成磷酸二氢钠和磷酸氢二钠的混合溶液进入聚合炉得到Na5P3O10,尾气洗涤塔气进入尾气洗涤塔后放空,
(1)燃磷时,必须通入足量的空气,保证磷燃烧充分生成五氧化二磷,燃磷水化塔中五氧化二磷和水反应生成磷酸;
(2)中和釜中发生反应是磷酸和碳酸钠反应生成磷酸氢二钠和磷酸二氢钠,二者按照2:1生成,同时生成二氧化碳和水,高温下在聚合炉中发生反应是磷酸氢二钠和磷酸二氢钠按照2:1聚合为Na5P3O10;
(3)该生产工艺对含磷废液及废气经处理后再排放是防止磷资源流失污染水体和环境,中和釜中排放出CO2通入“尾气碱洗塔”吸收生成碳酸钠,从而循环使用;
(4)样品溶于硝酸得到磷酸,加入利用氢氧化钠溶液调节溶液PH=3~4得到NaH2PO4,滴入cmol/L的NaOH溶液滴定反应得到Na2HPO4,消耗标准溶液VmL,依据磷元素守恒计算.
解答 解:白磷、空气、水蒸气进入燃磷水化塔发生反应生成磷酸进入酸槽,冷凝器中冷凝得到酸进入酸槽,尾气进入尾气碱洗塔吸收酸性气体二氧化碳生成碳酸钠循环使用,剩余尾气放空,得到磷酸进入中和釜加入纯碱和水发生反应生成磷酸二氢钠和磷酸氢二钠的混合溶液进入聚合炉得到Na5P3O10,尾气洗涤塔气进入尾气洗涤塔后放空,
(1)燃磷时,必须通入足量的空气,保证磷燃烧充分生成五氧化二磷,燃磷水化塔中五氧化二磷和水反应生成磷酸,反应的化学方程式为:P4+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5,P2O5+3H2O=2H3PO4,
故答案为:使白磷充分氧化;P4+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5,P2O5+3H2O=2H3PO4;
(2)中和釜中发生反应是磷酸和碳酸钠反应生成磷酸氢二钠和磷酸二氢钠,二者按照2:1生成,同时生成二氧化碳和水,反应的化学方程式为:6H3PO4+5CO32-=4HPO42-+2H2PO4-+5CO2↑+5H2O,高温下在聚合炉中发生反应是磷酸氢二钠和磷酸二氢钠按照2:1聚合为Na5P3O10,反应的化学方程式为:2Na2HPO4+NaH2PO4=Na5P3O10+2H2O,
故答案为:6H3PO4+5CO32-=4HPO42-+2H2PO4-+5CO2↑+5H2O;2Na2HPO4+NaH2PO4=Na5P3O10+2H2O;
(3)该生产工艺对含磷废液及废气经处理后再排放是防止磷资源流失污染水体和环境,含磷废水引发水体富营养化,中和釜中排放出CO2通入“尾气碱洗塔”吸收生成碳酸钠,从而循环使用,该生产工艺对含磷废液及废气经处理后再排放,其目的是防止磷资源流失及防止含磷废水引发水体富营养化,排放出CO2通入“尾气碱洗塔”吸收生成碳酸钠,从而循环使用,
故答案为:防止磷资源流失及防止含磷废水引发水体富营养化;通入“尾气碱洗塔”吸收生成碳酸钠,从而循环使用;
(4)样品溶于硝酸得到磷酸,加入利用氢氧化钠溶液调节溶液PH=3~4得到NaH2PO4,滴入cmol/L的NaOH溶液滴定反应得到Na2HPO4,消耗标准溶液VmL,依据磷元素守恒计算,Na5P3O10=~3H3PO4~3NaH2PO4~3Na2HPO4~3NaOH
1 3
n cmol/L×V×10-3L
n=$\frac{cV×1{0}^{-3}}{3}$mol
则质量分数w(Na5P3O10)=$\frac{\frac{cV×1{0}^{-3}}{3}×368g/mol}{mg}$×100%=$\frac{368cV}{30m}%$,
故答案为:$\frac{368cV}{30m}%$.
点评 本题考查了物质制备的方案分析,生产流程的理解应用,主要是题干信息的理解分析,化学方程式书写和含量计算是解题关键,题目难度中等.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 112.4 (100℃左右升华) | 248 | 1.2659 | 微溶 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
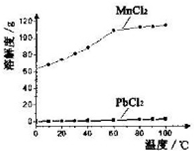
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
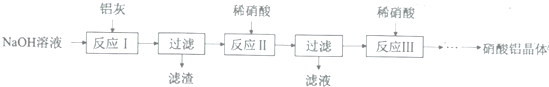
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |
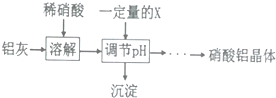
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y和 Z的原子半径大小顺序为 Y>Z>X | |
| B. | Z和 Y组成的化合物中一定既有离子键又有共价键. | |
| C. | 元素 X、Y、W各自最高和最低化合价的代数和分别为 0、4、4 | |
| D. | 同时含有 X、Y、Z、W四种元素的两种不同化合物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
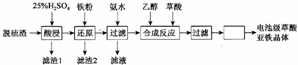
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B<A<D<C<E | B. | E<B<A<D<C | C. | B<A<E<D<C | D. | E<D<C<B<A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | 稀有气体原子的最外层电子数都为8 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | X2+的核外电子数目为10,则X在第三周期第ⅡA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com