
【题目】实验室常用锌与2mol·L-1盐酸溶液制取氢气。下列措施会降低H2产生速率的是
A. 用锌粉代替锌块
B. 向该盐酸溶液中加入少量的氯化钠固体(忽略溶液体积变化)
C. 改用4mol·L-1盐酸溶液
D. 向该盐酸溶液中加入等体积、等浓度的氯化钠溶液
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压×物质的量分数.在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便.下列说法不正确的是( )
A.对于C2H4 (g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为2 mol,则用分压表示的平衡常数Kp= ![]()
B.恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3mol N2 , 则平衡正向移动
C.恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和 C的物质的量分别为4mol、2mol和4mol,若此时A、B和C均减少1 mol,平衡逆向移动
D.对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种光化学电池的结构如图所示,电池总反应为:AgCl(s)+Cu+(aq)===Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是
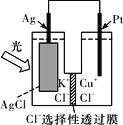
A. 生成108 g银,转移电子个数为1 mol
B. Cu+在负极发生氧化反应
C. Ag电极活泼,Ag失电子发生氧化反应
D. Cl-由负极迁移到正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)写出下列物质的电离方程式:
Ba(OH)2;
Fe2(SO4)3;
H2SO4 .
(2)如果NaHSO4的电离方程式可以写成:NaHSO4=Na++H++SO42﹣ . 那么,将NaHSO4溶液与氢氧化钠溶液完全反应的离子方程式是: .
(3)用“双线桥”法,对反应MnO2+4HCl=MnCl2+Cl2+2H2O进行化合价变化、电子转移以及氧化、还原分析. , 其中氧化剂是 , 还原剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合理膳食、均衡营养是保证人体健康和生活质量的重要途径。
①人体必需的元素摄入不足会影响人体的正常生理活动。下列做法不能达到目的的是______。
a.补碘——食用加碘盐 b.补铁——使用铁强化酱油 c.补钙——服用葡萄糖
②人体内有8种氨基酸必需通过食物摄入,某品牌饼干含有的下列物质中能转化为氨基酸的是______。
a.纤维素 b.蛋白质 c.油脂
③人类历史上最重要的抗生素是______。
a.青霉素 b.维生素 c.胡萝卜素
(2)构建人与自然的和谐、营造安全的生态环境已成为全人类的共识。
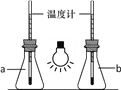
①如图,向两只250mL的锥形瓶中分别充入CO2和空气,用白炽灯泡照射一段时间后,其中a瓶中温度计读数稍低,则盛放CO2的锥形瓶为______(填“a”或“b”)。
②为防止白色污染,废旧的塑料需投入到贴有如图标志的垃圾桶内,该标志表示的是______。

③废水中铊(Tl)具有高毒性,治理时常加入NaClO溶液,将Tl+转变为Tl3+,NaClO作_____(填“氧化剂”或“还原剂”),同时加入适量氨水,将Tl3+转变为难溶物Tl(OH)3,写出生成Tl(OH)3的离子方程式______。
(3)材料是人类社会发展的物质基础,材料科学的发展离不开化学。
①黏土是陶瓷的生产原料,其中江苏宜兴的高岭土是含有杂质较少的高品质黏土,其主要组成可表示为Al2Si2Ox(OH)4,则x=______。
②2016年奥运会在巴西举行,场馆的建设需大量的建筑材料。其中生产水泥、玻璃共同的原料是______(填名称),场馆内的座椅通常用高密度聚乙烯(HDPE)为原料制得,聚乙烯属于______塑料(填“热固性”或“热塑性”)。
③沪通铁路建设正在积极推进,其中如何防止铁轨的腐蚀是工程技术人员攻克的难题之一。铁在发生电化学腐蚀时的负极反应方程式为______。
④工业上常用SiCl4与O2在高温条件下通过置换反应制得SiO2,并于2000℃下拉成光纤细丝。该反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A= , C= , E=
实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | A | B | C | 30 | t2 |
③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式 .
(3)若t1<t2 , 则根据实验①和②得到的结论是 .
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是: 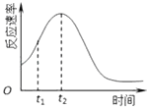
①;②
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O42H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:;实验中所需的定量仪器有(填仪器名称).该KMnO4溶液的物质的量浓度为mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com