
第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减少温室气体排放量。
Ⅰ.CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应①:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H1=﹣49.58kJ•mol﹣1
CH3OH(g)+H2O(g)△H1=﹣49.58kJ•mol﹣1
反应②:CO2(g)+H2(g)  CO (g)+H2O(g)△H2
CO (g)+H2O(g)△H2
反应③:CO(g)+2H2(g)  CH3OH(g)△H3=﹣90.77kJ•mol﹣1,回答下列问题:
CH3OH(g)△H3=﹣90.77kJ•mol﹣1,回答下列问题:
(1)反应②的△H2= ,反应 ① 自发进行条件是 (填“较低温”、“较高温”或“任何温度”)。
(2)某温度下,在体积为2 L的恒容密闭容器中,按如下方式加入反应物,仅发生反应①。一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 2mol CO2、6mol H2 | a mol CO2、b mol H2 c mol CH3OH(g)、c mol H2O(g) |
测得甲中CO2和CH3OH(g)的浓度随时间变化如图所示。
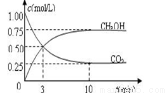
①前3min内,平均反应速率v(H2)= mol·L-1·min-1。此温度下该反应的平衡常数为
(结果保留两位小数) 。
②下列措施中,既能使反应速率加快,又能使n(CH3OH)/n(CO2)增大是 。
A.升高温度 B.充入惰性气体
C.将H2O(g)从体系中分离 D.再充入1mol H2
E.再充入1 mol CO2 F.加入催化剂
③反应达到平衡后,若向反应体系再加入CO2(g)、H2(g) 、CH3OH(g)、H2O(g)各1mol,化学平衡
(填“正向”、“逆向”或“不”)移动。
④要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
Ⅱ.工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(H2NCOONH4)。氨基甲酸铵极易发生:H2NCOONH4+2H2O  NH4HCO3+NH3·H2O,该反应酸性条件下更彻底。25℃,向l L 0.1 mol·L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052 mol氨基甲酸铵。若此时溶液中几乎不含碳元素,则该溶液中 c(NH4+)=____________,NH4+水解常数Kh=________。
NH4HCO3+NH3·H2O,该反应酸性条件下更彻底。25℃,向l L 0.1 mol·L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052 mol氨基甲酸铵。若此时溶液中几乎不含碳元素,则该溶液中 c(NH4+)=____________,NH4+水解常数Kh=________。
科目:高中化学 来源:2015-2016学年河北省、永年二中高一下学期期中化学试卷(解析版) 题型:选择题
下列判断错误的是( )
A.沸点:NH3>PH3>AsH3
B.熔点:SiO2>NaCl>CH4
C.酸性:HClO4>H2SO4>H3PO4
D.碱性:NaOH>Mg(OH) 2>Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中文科化学试卷(解析版) 题型:选择题
下列关于食品添加剂的说法不正确的是
A.亚硝酸钠可以致癌
B.我们应该禁止使用防腐剂
C.苯甲酸钠可用作防腐剂
D.绝大多数食品添加剂在过量使用时对人体有害的
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:填空题
某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用。某校研究小组尝试回收废旧正极材料中的钴。
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
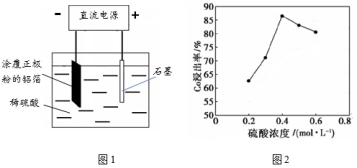
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O、 。
阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol/L时,钴的浸出率下降,其原因可能为
。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式: 。该步骤一般在80℃以下进行,温度不能太高的原因是 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
A.c(NH4+) > c(C2O42-) > c(H+) > c(OH-)
B.c(H+) + c(NH4+) = c(C2O42-) + c(OH-) + c(HC2O4-)
C.c(NH4+) + c(NH3·H2O) = 2[c(C2O42-) + c(HC2O4-) + c(H2C2O4 )]
(3)已知所用锂离子电池的正极材料为x g,其中LiCoO2 的质量分数为a%,则回收后得到CoC2O4·2H2O 的质量不高于 g。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.测定相同温度下盐酸和醋酸溶液的pH,可证明盐酸是强酸、醋酸是弱酸
B.改变温度能改变任何可逆反应的平衡状态
C.离子反应的结果是自由移动的离子浓度减小
D.Fe(OH)3胶体和饱和FeCl3溶液都呈红褐色,可通过丁达尔效应区分二
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三考前训练一理综化学试卷(解析版) 题型:选择题
乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2 =CH2 + O2 → 2CH3CHO。下列有关说法正确的是( )
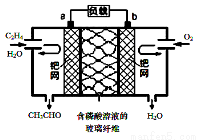
A.a电极发生还原反应
B.放电时,每转移2mol电子,理论上需要消耗28g乙烯
C.b极反应式为:O2+4e-+2H2O=4OH-
D.电子移动方向:电极a→磷酸溶液→电极b
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二下期中化学试卷(解析版) 题型:选择题
烯烃或炔烃在酸性高锰酸钾溶液作用下,分子中的不饱和键完全断裂,此法可用于减短碳链或利用产物反推不饱和烃的结构等。已知烯烃与酸性 KMnO4溶液反应的氧化产物的对应关系为
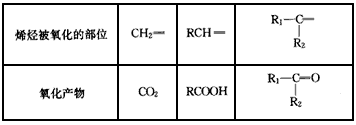
现有某烯烃与酸性KMnO4溶液作用后得到的氧化产物有CO2、乙二酸(HOOC-COOH)和丙酮 (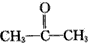 ),则该烯烃结构简式可能是
),则该烯烃结构简式可能是
A.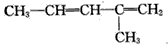
B.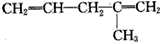
C. CH2=CH-CH=CHCH2CH3
D.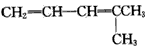
查看答案和解析>>
科目:高中化学 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:填空题
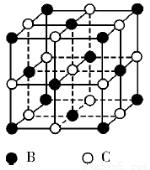
【选修3 :物质结构与性质】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均不大于30)。A的基态原子2p能级有3个单电子;C的核外没有成单电子,B、C两元素形成的化合物晶胞结构如下图所示;D的3p能级有1个单电子,且与B所在主族相邻;E元素在地壳中含量居第四位;则:
(1)写出基态E原子的价电子排布式 。
(2)A的最简单氢化物分子的空间构型为 ,其中A原子的杂化类型是 。
(3)B能形成两种常见的单质,其分子式分别为 ,其沸点是同族元素氢化物中最高的因是 。
(4)A和D形成的化合物中,D显正化合价,试写出该化合物与水反应的方程式: 。
(5)B、C两元素形成的化合物晶胞结构中,B原子是堆积_______(填堆积模型);已知B和C形成的化合物晶体的密度为ρg • cm-3,阿伏加德罗常数为 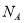 ,求晶胞边长a = cm。(用含
,求晶胞边长a = cm。(用含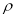 、
、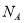 的计算式表示)
的计算式表示)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一下期中化学试卷(解析版) 题型:选择题
元素在周期表中的位置反映了元素的原子结构和元素的性质,下列说法正确的是
A.第一主族的元素称为碱金属
B.第二周期元素的最高化合价依次递增,并等于它所处的主族序数
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数一定相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com