
����Ŀ��ij�������������Al����NH4��2SO4��MgCl2��FeCl2��AlCl3�е�һ�ֻ�����ɣ��ֶԸû����������ʵ�飬����������й�������ͼ��ʾ��������������ѻ���ɱ�״���µ�������� 
����˵����ȷ���ǣ� ��
A.����������һ������Al������������ȷ��
B.���������п��ܺ���MgCl2��AlCl3
C.����������һ������MgCl2��FeCl2
D.����������һ�����У�NH4��2SO4��MgCl2
���𰸡�D
���������⣺14.05g����������������������Һ�������壬����κͼӦ�������ɵİ�����Ҳ�����ǽ�����������������Һ��Ӧ����������5.60L����ͨ����ʯ���ޱ仯��˵�������������ʯ�ҷ�Ӧ�����壬��ˮ�����Ĵ��ڣ�ͨ��Ũ���ᣬ����ʣ��3.36L���������5.60L��3.36L=2.24L����ϻ������ܴ��ڵ����ʿ�֪��һ��������������������Ʒ�Ӧ���ɰ���Ϊ2.24L��ʣ�������ֻ�������������Ϊ3.36L��˵��ԭ�������һ���������� 14.05g����������������������Һ�в�����ɫ����2.9g�������ޱ仯������������������ǿ����������ɰ�ɫ������һ���Ȼ�þ���ɵ�������þ��ɫ����������Ϊ2.90g��������ͭΪ��ɫ���������Թ���������һ��������CuCl2��
14.05g����������������������Һ�õ���ɫ��Һ�������������� �����ɳ�����˵�����������Ȼ���������Ӧ���ɵ�ƫ�����������ᷴӦ���ɵ������������������������������ܽ��һ��֤������������������
A������������һ������Al�����Ը��ݱ����3.36L�������Լ�����������ʵ���Ϊ0.05mol������Ϊ1.35g����A����
B���������Ϸ�����֪������������һ������MgCl2��AlCl3 �� ��B����
C�����ݼ�������������Һ�����ɰ�ɫ�������Ұ�ɫ����û�б仯�������������һ������MgCl2 �� һ������FeCl2 �� ��C����
D���������Ϸ�����֪��ԭ����������һ�����У�NH4��2SO4��MgCl2 �� ��D��ȷ��
��ѡD��


 ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ҫʹ�����б����������Դ�õ�������ã�������������з��࣬��ͬ�����������ͬ����ͼ��һЩ�������õ���������ͼ�� 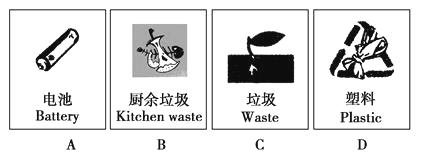
��1��ͼC��������ģ�����壬��ͼ�п��Կ�������ʾ���ǣ���
A.�ɻ�����
B.�ɶѷ�����
C.��ȼ����
D.�����
��2��������ͼ�������ڶѷʴ�����������
��3��ͼD��ʾ�����������ⶪ��������ɻ�����Ⱦ��������Ⱦͨ����Ϊ����������Ҫ�����ࡢ�ࡢ�۱�ϩ���
��4��ͼA�ϵ����Ҫ���д�������Ҫԭ���ǵ���е��������������н�������ʱ����ͨ��������Ⱦˮ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. 1Ħ����6.02��1023�����ʵļ���
B. ÿĦ�����ʺ���NA��ָ���Ľṹ��
C. 0.012 kg12C������ԭ����Ŀ��6.02��1023��
D. 1 mol MgCl2��������95 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���3molA��l mol B�����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A��g��+B��g��C��g��+2D��s��.2minĩ�÷�Ӧ�ﵽƽ�⣬����D�����ʵ�����ʱ��仯�����ͼ�������ж���ȷ���ǣ� �� 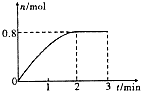
A.�����������ܶȲ��ٸı�ʱ���÷�Ӧ��һ���ﵽƽ��״̬
B.2 min��ѹ��ʹ����Ӧ���ʼӿ죬�淴Ӧ���ʱ�����ƽ�������ƶ�
C.��Ӧ������A��B��ת����֮��Ϊ3��1
D.��ʼ��ƽ�⣬��A��ʾ�÷�Ӧ�Ļ�ѧ��Ӧ����Ϊ0.3molL��1min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Mg2+��NH4+��Al3+�����Һ�м���Na2O2���������ɳ�������������������꣩�Ĺ�ϵ��ͼ��ʾ������Һ���������ӵ����ʵ���֮��Ϊ��������
A.2��1��2
B.1��2��2
C.2��2��1
D.9��2��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������NaOH��Һ����μ���AlCl3��Һ�����ɳ���Al��OH��3������AlCl3�������ı仯��ϵ��ͼ��ʾ���������������ڶ�Ӧ����Һ��һ���ܴ���������ǣ�������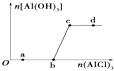
A.a���Ӧ����Һ�У�Na+��Fe3+��SO42����HCO3��
B.b���Ӧ����Һ�У�Na+��S2����SO42����Cl��
C.c���Ӧ����Һ�У�K+��Ag+��Ca2+��NO3��
D.d���Ӧ����Һ�У�K+��NH4+��CO32����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ͨ��������ͼ��ʾװ�ã��г�װ����ȥ��ʵ�飬̽��SO2��Na2O2��Ӧ�IJ���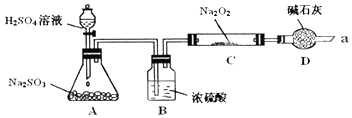
��1���������
��װ��B������װ��D������
��C�й������������¼��裺����1��ֻ��Na2SO3 ����2��ֻ��Na2SO4����3��
��������2���У���Ӧ����ʽΪ
��2����Na2O2��Ӧ��ȫ��Ϊȷ��C�й������ijɷ֣���ͬѧ�������ʵ�飺�ó����ۣ�����2����
C�еĹ��������Һ ![]() ��ɫ����
��ɫ���� ![]() �������ܽ�
�������ܽ�
�÷����Ƿ��������ǡ�����������
��3��������2��������Ӧǰ��C������6.4g�������10g�������ʵ�Na2O2�����У�Na2O2����������Ϊ�����������ʲ���SO2������Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ɱ���ܱ������з�����Ӧ��CO(g) + H2O(g) CO 2 (g) + H2O(g)������ӦΪ���ȷ�Ӧ�����ı���������������ʹ���� �������
A. �����¶�B. ���ݳ�He
C. ��С�������D. ����ʱ��������H2O(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���ᴿ��������(������Ϊ����R��ѡ�õij����Լ�����ӷ�������ȷ����
������ | �����Լ� | ���ӷ��� | |
A. | ����(��ϩ�� | H2 | Ni/���� |
B. | �Ҵ�(ˮ�� | CuSO4 | ���� |
C. | ��������(����) | ����Na2CO3��Һ | ��Һ |
D. | ����(ˮ�� | Na | ���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com