
实验中需要2 mol·L-1的Na2CO3溶液950 mL,配制时,你认为应该选用的容量瓶的规格和称取的碳酸钠质量分别是________、________。
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3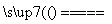 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
观察两个试剂瓶上的标签,回答下列问题。

(1)“5%硫酸铜溶液”中的5%是什么含义?
(2)0.4 mol·L-1 NaCl溶液中的0.4 mol·L-1表示的含义是什么?
(3)从上述两种溶液中分别取出5 mL,硫酸铜溶液的质量分数为__________,NaCl溶液的浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
两种硫酸溶液,一种硫酸溶液的物质的量浓度为c1,密度为ρ1;另一种硫酸溶液的物质的量浓度为c2,密度为ρ2,将它们等体积混合后,所得溶液的密度为ρ3,则混合后硫酸的物质的量浓度为( )
A.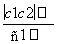 B.
B.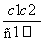
C.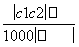 D.
D.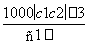
查看答案和解析>>
科目:高中化学 来源: 题型:
请填写下列物质的结晶方法。
(1)氯化钠:________________。
(2)硝酸钾:________________。
(3)硫酸铜晶体:______________。
(4)从FeCl3溶液中得到FeCl3·6H2O固体__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中,溶质的物质的量浓度不是1 mol·L-1的是( )
A.10 g NaOH固体溶解在水中配成250 mL溶液
B.将80 g SO3溶于水并配成1 L的溶液
C.将0.5 mol·L-1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D.标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
当下列物质以晶体形式存在时,其所属晶体类型和所含化学键类型分别相同的是( )
A.氯化钠和氯化氢 B.二氧化碳和二氧化硅
C.四氯化碳和四氯化硅 D.单质铁和单质碘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com