
【题目】N2O5是一种新型硝化剂,一定温度下发生反应2N2O5(g)4NO2(g)+O2(g) ΔH>0, T1温度下的部分实验数据如下表所示。
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/(mol/L) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 该反应在任何温度下均能自发进行
B. T1温度下的平衡常数为K1=125,1 000 s时N2O5(g)转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
【答案】B
【解析】
A.该反应为熵增、焓增的反应,根据△G=△H-T△S,高温有利于自发进行;B.由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,计算平衡浓度结合平衡常数概念计算平衡常数,根据转化率=![]() ×100%计算;C.该反应正反应是吸热反应,升高温度,反应速率加快,平衡向正反应移动,平衡时时N2O5(g)浓度应降低;D.平衡常数只受温度影响。
×100%计算;C.该反应正反应是吸热反应,升高温度,反应速率加快,平衡向正反应移动,平衡时时N2O5(g)浓度应降低;D.平衡常数只受温度影响。
A.该反应为熵增、焓增的反应,根据△G=△H-T△S,高温有利于自发进行,选项A错误;B.由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,c(NO2)=5mol/L,c(O2)=1.25mol/L,平衡常数K=![]() =
=![]() =125,转化率为
=125,转化率为![]() ×100%=50%,选项B正确;C.该反应正反应是吸热反应,升高温度,反应速率加快,平衡向正反应移动,平衡时时N2O5(g)浓度应降低,其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,浓度大于2.5mol/L,故不可能为升高温度,应为降低温度,故T1>T2,选项C错误;D.平衡常数只受温度影响,T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,反应吸热反应,则K1>K2,选项D错误;答案选B。
×100%=50%,选项B正确;C.该反应正反应是吸热反应,升高温度,反应速率加快,平衡向正反应移动,平衡时时N2O5(g)浓度应降低,其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,浓度大于2.5mol/L,故不可能为升高温度,应为降低温度,故T1>T2,选项C错误;D.平衡常数只受温度影响,T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,反应吸热反应,则K1>K2,选项D错误;答案选B。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随加入的c(HC2O4-)的变化趋势如下图所示。下列说法正确的是( )

A. 当c(HC2O4-)=0.1mol/L时,c(H+)>c(C2O42-)-c(H2C2O4)
B. 当c(HC2O4-)>amol/L时,c(H+)< c(H2C2O4),HC2O4-的水解程度大于电离程度
C. HC2O4-![]() C2O42-+H+,Ka(HC2O4-)=a
C2O42-+H+,Ka(HC2O4-)=a
D. 将0.08mo1/L H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作催化剂、杀菌剂等。
(1)将Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量浓盐酸混匀,得到CuCl沉淀。该反应中被氧化的物质是______(填化学式)。
(2)为测定制得CuCl样品的纯度,进行下列实验:a.称取0.5000 g样品,放入盛有 20 mL过量FeCl3溶液和玻璃珠的锥形瓶中,不断摇动;b.待样品溶解后,加水50 mL;c.立即用0.2000 mol·L-1 Ce(SO4)2标准溶液滴至反应完全,记录消耗标准溶液的体积; d.重复步骤a至c 2次,记录消耗标准溶液的平均体积为25.00 mL。
已知:CuCl + Fe3+ = Cu2+ + Fe2+ + Cl- Fe2+ + Ce4+ = Fe3+ + Ce3+
①配制100 mL 0.2000 mol·L-1 的Ce(SO4)2标准溶液时,需要的玻璃仪器除烧杯、量筒、玻璃棒、100 mL容量瓶外,还需要_______。
②通过计算确定该样品中CuCl的纯度。______
③进行步骤c时若操作缓慢,则测得CuCl的纯度_______(“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是

A.该过程中可得到化工产品H2SO4
B.该工艺流程是除去煤燃烧时产生的SO2
C.该过程中化合价发生改变的元素为Fe和S
D.图中涉及到的反应之一为Fe2(SO4)3 + SO2 + 2H2O == 2FeSO4 + 2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如图所示:
NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是____mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为____。
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx―→N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数之比为____。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
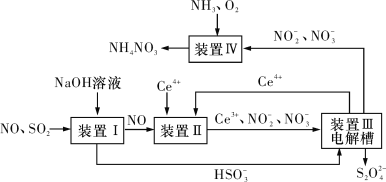
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是![]() 和
和![]() ,请写出生成等物质的量的
,请写出生成等物质的量的![]() 和
和![]() 时的离子方程式:__。
时的离子方程式:__。
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的___(填“阳极”或“阴极”),同时在另一极生成![]() 的电极反应式为____。
的电极反应式为____。
(5)已知进入装置Ⅳ的溶液中![]() 的浓度为a g·L-1,要使1 m3该溶液中的NO
的浓度为a g·L-1,要使1 m3该溶液中的NO![]() 完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___L(用含a代数式表示,结果保留整数)。
完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2、稀硝酸的还原产物为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与稀HNO3反应制取NO的化学方程式并用双线桥标明电子的转移方向及数目_________________
(2)64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗的HNO3的物质的量是_________(填字母代号)。
A.0.5mol B. 1.0mol C. 2.0mol D. 3.0mol
产生的气体分别是_______________,其物质的量之比是_______________
(3)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等,请将下列3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,并配平该反应的化学方程式。___HNO3+_______→ _______+ _______ +___ NO↑+___H2O
(4)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念--“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是_______(填字母代号)。
A.Cu![]() Cu(NO3)2
Cu(NO3)2
B.Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C.Cu![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为金属单质,下列物质相互转化如图所示:

试回答:
(1)写出B的化学式________,D的化学式_________。
(2)写出由E转变成F的化学方程式____________________________________。
(3)检验G溶液中阳离子的试剂为__,写出发生反应的离子方程式____________。
(4)某同学取B的溶液酸化后加入碘化钾淀粉溶液,在空气中放置一会儿变为蓝色,写出与上述变化过程相关的离子方程式__________________,____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种既能提供电能又能固氮的新型氢氮燃料电池的工作原理如图所示,其中电解质溶液为溶有化合物A的稀盐酸。下列有关表述正确的是( )

A. 通入N2的电极发生的电极反应式为N2-6e-+8H+=2NH4+
B. 该装置能将化学能转化为电能,化合物A 为NH4Cl
C. 电子从通入N2的电极流出,经过用电器流向通入H2的电极
D. 反应过程中电解质溶液的pH变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com