
【题目】空气吹出法是目前“海水提溴”使用到的主要方法之一。其工艺流程如下:
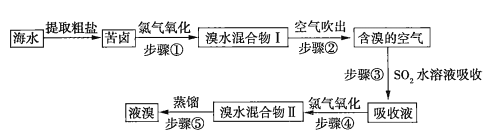
(1)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过___________(填化合物名称)溶液,以除去氯气。
(2)步骤⑤的蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因_____________。
(3)步骤①中用硫酸酸化可提高![]() 的利用率,理由是__________。
的利用率,理由是__________。
(4)提取溴单质时,蒸馏溴水混合物Ⅱ而不是蒸馏溴水混合物Ⅰ,请说明原因:_________。
【答案】溴化铁 温度过高,大量水被蒸出;温度过低,溴不能被完全蒸出 酸化可抑制![]() 、
、![]() 与水反应 将溴水混合物Ⅰ转变为溴水混合物Ⅱ是
与水反应 将溴水混合物Ⅰ转变为溴水混合物Ⅱ是![]() 的富集浓缩过程,蒸馏溴水混合物Ⅱ可提高效率,减少能耗,降低成本
的富集浓缩过程,蒸馏溴水混合物Ⅱ可提高效率,减少能耗,降低成本
【解析】
从海水中提取澳,一般要经过浓缩、氧化、提取三个步骤。步骤①发生的反应是![]() ,生成的溴仍溶解在海水中,依裾澳的沸点比水的低,鼓入热空气(步骤②),使溴挥发出来,再用
,生成的溴仍溶解在海水中,依裾澳的沸点比水的低,鼓入热空气(步骤②),使溴挥发出来,再用![]() 水溶液吸收(步骤③):
水溶液吸收(步骤③):![]() ,这样可以得到
,这样可以得到![]() 浓度较大的溶液,进一步用氯气氧化(步骤④),可得到含
浓度较大的溶液,进一步用氯气氧化(步骤④),可得到含![]() 的水溶液,然后蒸馏即得到液溴。
的水溶液,然后蒸馏即得到液溴。
(1)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过溴化铁溶液,发生反应![]() ,以除去氯气,
,以除去氯气,
故答案为:溴化铁;
(2)步骤⑤的蒸馏过程中,温度应控制在80~90℃,温度过高,大量水被蒸出;温度过低,溴不能被完全蒸出,
故答案为:温度过高,大量水被蒸出;温度过低,溴不能被完全蒸出;
(3)![]() ,
,![]() 加入硫酸酸化可以使平衡左移,可抑制
加入硫酸酸化可以使平衡左移,可抑制![]() 、
、![]() 与水反应,提高
与水反应,提高![]() 的利用率,
的利用率,
故答案为:酸化可抑制![]() 、
、![]() 与水反应;
与水反应;
(4)提取溴单质时,蒸馏溴水混合物Ⅱ而不是蒸馏溴水混合物Ⅰ原因是将溴水混合物Ⅰ转变为溴水混合物Ⅱ是![]() 的富集浓缩过程,蒸馏溴水混合物Ⅱ可提高效率,减少能耗,降低成本,
的富集浓缩过程,蒸馏溴水混合物Ⅱ可提高效率,减少能耗,降低成本,
故答案为:将溴水混合物Ⅰ转变为溴水混合物Ⅱ是![]() 的富集浓缩过程,蒸馏溴水混合物Ⅱ可提高效率,减少能耗,降低成本。
的富集浓缩过程,蒸馏溴水混合物Ⅱ可提高效率,减少能耗,降低成本。


科目:高中化学 来源: 题型:
【题目】呋喃酚是合成农药的重要中间体,其合成路线如下:
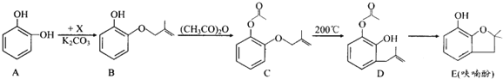
![]() 物质核磁共振氢谱共有 ______ 个峰,
物质核磁共振氢谱共有 ______ 个峰,![]() 的反应类型是 ______ ;E中含有的官能团名称是 ______ ;
的反应类型是 ______ ;E中含有的官能团名称是 ______ ;
![]() 已知X的分子式为
已知X的分子式为![]() ,写出
,写出![]() 的化学方程式: ______ ;
的化学方程式: ______ ;
![]() 是X的同分异构体,分子中无支链且不含甲基,则Y的名称
是X的同分异构体,分子中无支链且不含甲基,则Y的名称![]() 系统命名
系统命名![]() 是 ______ ;
是 ______ ;
![]() 下列有关化合物C、D的说法正确的是 ______ ;
下列有关化合物C、D的说法正确的是 ______ ;
①可用氯化铁溶液鉴别C和D ②![]() 和D含有的官能团完全相同 ③
和D含有的官能团完全相同 ③![]() 和D互为同分异构体 ④
和D互为同分异构体 ④![]() 和D均能使溴水褪色
和D均能使溴水褪色
![]() 的同分异构体很多,写出符合下列条件的芳香族同分异构体的结构简式: ______ ;
的同分异构体很多,写出符合下列条件的芳香族同分异构体的结构简式: ______ ;
①环上的一氯代物只有一种②含有酯基③能发生银镜反应
![]() 为B的同系物,F的相对分子质量比B少14,F的同分异构体可与
为B的同系物,F的相对分子质量比B少14,F的同分异构体可与![]() 反应放出气体,则F的同分异构体共有 ______ 种.
反应放出气体,则F的同分异构体共有 ______ 种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
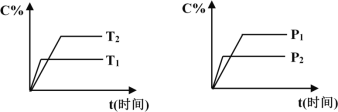
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的分子结构如图所示。现有试剂:①Na ②H2/Ni ③Ag(NH3)2OH ④新制Cu(OH)2 ⑤NaOH ⑥酸性KMnO4溶液。能与该化合物中两个或两个以上官能团都发生反应的试剂有( )

A.①②⑤⑥ B.①②④⑥ C.①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的醋酸,某学生用0.100 mol/L NaOH标准溶液进行测定醋酸的浓度的实验,取20.00mL待测醋酸放入锥形瓶中,并滴加2~3滴指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。完成下列填空:
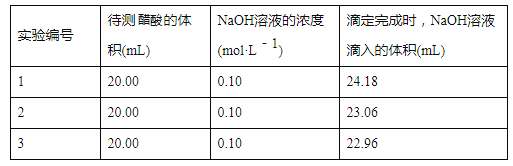
(1)量取醋酸用的仪器是__________,该实验中指示剂最好选用________,滴定时眼睛应注视________,滴定达到终点的标志是_________。
(2)排除碱式滴定管尖嘴中气泡的方法应采用以下_________操作(填甲/乙/丙),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)根据上述数据,可计算出该醋酸的浓度约为_________ (保留小数点后3位)。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________。
A.用滴定管取20.00mL待测醋酸,使用前,水洗后未用待测醋酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积和浓度均为25.00mL0.1mol/LNaI、NaBr及NaCl三种溶液,分别用0.1mol/L的AgNO3溶液滴定,滴定曲线如图所示[pAg=-lgc(Ag+)]。下列说法不正确的是( )
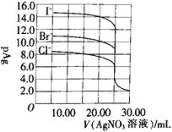
A.Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl)
B.AgNO3溶液滴定Cl-时,可加入少量的KI作滴定指示剂
C.三种溶液等体积等浓度混合后用AgNO3溶液滴定,沉淀顺序为I-、Br-、Cl-
D.当V(AgNO3)=30.00mL时,三种溶液中:c(I-)<c(Br-)<c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活息息相关。
(1)在现代化学中,常利用________上的特征谱线来鉴定元素,称为光谱分析。
(2)基态N原子的价电子占据的能量最高的能级是________,价电子在该能级上的排布遵循的原则是_____________。
(3)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。lmolNH4BF4含有______mol配位键。
(4)化肥(NH4)2SO4中会含有N4H4(SO4)2,该物质在水中电离出SO42-和N4H44+,N4H44+遇到碱性溶液会生成一种形似白磷(P4)的N4分子。N4比P4的沸点________,原因为_______________________。

(5)尿素(H2NCONH2)也是一种常用的化肥,其分子中原子的杂化轨道类型有________,σ键和π键数目之比为__________。
(6)Cu3N具有良好的电学和光学性能,其晶胞结构如图。Cu+半径为a pm,N3-半径为b pm,Cu+和N3-都是紧密接触的刚性小球,则N3-的配位数为________,Cu3N的密度为________g·cm-3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1) SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式___________。
(2) SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=+48 kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH为____kJ·mol-1。
(3)对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
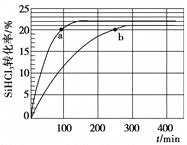
①343 K时,反应的平衡转化率α=________%。平衡常数K343 K=________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是______;要缩短反应达到平衡的时间,可采取的措施有_________。
(4)甲醇水蒸气重整制氢(SRM)系统简单,产物中H2 含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应I(主) :CH3OH(g)+ H2O(g) ![]() CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
反应II(副) :H2(g)+ CO2(g) ![]() CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol
温度高于300℃则会同时发生反应III: CH3OH(g) ![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
反应1能够自发进行的原因是_________,升温有利于提高CH3OH转化率,但也存在一个明显的缺点是________。写出一条能提高CH3OH转化率而降低CO生成率的措施_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除![]() 外,还有( )
外,还有( )
A.7种B.11种C.16种D.17种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com