
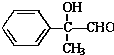
 某有机物如图所示,该有机物不可能发生的化学反应是( )
某有机物如图所示,该有机物不可能发生的化学反应是( )| A. | ①④ | B. | ⑦ | C. | ②⑤ | D. | ②⑦ |
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Ⅰ.Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焓变单位中kJ•mol-1,是指1 mol物质参加反应时的能量变化 | |
| B. | 反应热的大小与反应的途径有关,无论是一步完成还是分几步完成,其反应热基本相同 | |
| C. | 一个化学反应中,反应物的总键能大于生成物的总键能时,反应吸热,△H>0 | |
| D. | 一个化学反应中,反应物的总能量小于生成物的总能量时,反应放热,△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯是纯净物 | |
| B. | 合成聚氯乙烯的单体是CH2=CH-Cl | |
| C. | 聚氯乙烯的长链上含有碳碳双键 | |
| D. | 聚氯乙烯分子中的化学键在自然界中容易断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 3.36g | C. | 4.2g | D. | 5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,有关它的下列叙述不正确的是( )
,有关它的下列叙述不正确的是( )| A. | 它完全燃烧时的产物是P2O5 | B. | 它不溶于水 | ||
| C. | 它在常温下呈固态 | D. | 它与白磷互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com