
【题目】在容积为1.00L的容器中,通入一定量的N2O4 , 发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
(1)反应的△H0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示.在0~60s时段,反应速率v(N2O4)为molL﹣1s﹣1反应的平衡常数K1= . 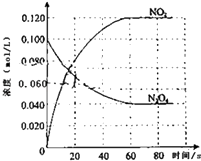
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL﹣1s﹣1的平均速率降低,经10s又达到平衡.
①T100℃(填“大于”“小于”),判断理由是
②温度T时反应的平衡常数K2=
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向(填“正反应”或“逆反应”)方向移动,判断的理由是: .
(4)综合(1)、(2)小题信息你得出温度对平衡常数的影响规律是: .
【答案】
(1)大于;0.0010;0.36mol/L
(2)大于;c(N2O4)降低,平衡正向移动,正反应为吸热反应,故温度升高;1.28mol/L
(3)逆反应;增大压强平衡向逆反应方向移动
(4)吸热反应升高温度平衡常数增大
【解析】解:(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;0~60s时段,N2O4浓度变化为:0.1mol/L﹣0.04mol/L=0.06mol/L,v(N2O4)= ![]() =0.0010molL﹣1s﹣1;K=
=0.0010molL﹣1s﹣1;K= ![]() =
= ![]() =0.36mol/L,
=0.36mol/L,
所以答案是:大于;0.0010molL﹣1s﹣1;0.36mol/L;(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,所以答案是:大于;c(N2O4)降低平衡正向移动,正反应为吸热反应,故温度升高;
②平衡时,c(NO2)=0.120molL﹣1+0.0020molL﹣1s﹣1×10s×2=0.16molL﹣1 , c(N2O4)=0.040molL﹣1﹣0.0020molL﹣1s﹣1×10s=0.020molL﹣1 , K2= ![]() =1.28mol/L,所以答案是:1.28mol/L;(3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动,所以答案是:逆反应;增大压强平衡向逆反应方向移动;(4)综合(1)、(2)小题信息你得出温度对平衡常数的影响规律是:吸热反应升高温度平衡常数增大,所以答案是:吸热反应升高温度平衡常数增大.
=1.28mol/L,所以答案是:1.28mol/L;(3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动,所以答案是:逆反应;增大压强平衡向逆反应方向移动;(4)综合(1)、(2)小题信息你得出温度对平衡常数的影响规律是:吸热反应升高温度平衡常数增大,所以答案是:吸热反应升高温度平衡常数增大.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有一瓶乙二醇和丙三醇的混和物,已知它们的性质如下表,据此,将乙二醇和丙三醇互相分离的最佳方法是( )
物质 | 分子式 | 熔点℃ | 沸点℃ | 密度(g/cm3) | 溶解性 |
乙二醇 | C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
A.结晶法B.萃取法C.分液法D.蒸馏法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液,不合理的操作顺序是
A. ④②⑤①③ B. ⑤④②①③ C. ②⑤④①③ D. ⑤②④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同体积同物质的量浓度的AgNO3溶液中分别加入同体积的NaCl、MgCl2、AlCl3溶液,恰好使Cl-完全转化为沉淀,则三种溶液的物质的量浓度之比为
A. 1:1:1 B. 1:2:3 C. 1:4:9 D. 6:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行反应:mX(g)+nY(g)![]() pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3min内,各物质物质的量的变化如下表所示:
物质 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知:2min内,ν(Q)=0.075mol·L-1·min-1,ν(Z)∶ν(Y)=1∶2。
(1)方程式中m=______,n=______,p=______,q=______。
(2)2.5min内,Q的转化率为______________。
(3)对于该反应,能增大正反应速率的措施是___________
A.增大容器体积 B.移走部分Q C.通入大量X D.升高温度
(4)该反应达到化学平衡状态时___________
A.容器内气体压强保持不变 B.容器内气体密度保持不变
C.容器内气体平均摩尔质量保持不变 D.正反应速率与逆反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使相同体积的NaCl、CaCl2、AlCl3溶液中的Cl﹣全部沉淀,用去同浓度的AgNO3溶液的体积分别为3V、2V、V,则NaCl、CaCl2、AlCl3溶液的物质的量浓度之比为( )
A.6:3:2
B.3:2:1
C.9:3:1
D.1:2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com