
下列说法正确的是( )
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊溶液褪色
B.能使品红溶液褪色的物质不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,但原理不都相同
D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
科目:高中化学 来源: 题型:
把200 mL NH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a mol NaOH的溶液恰好反应完全;取另一份加入含b mol HCl的盐酸恰好反应完全。该混合溶液中c(Na+)为( )
A.(10b-5a)mol·L-1 B.(2b-a)mol·L-1
C.( -
-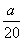 )mol·L-1 D.(5b-
)mol·L-1 D.(5b-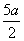 )mol·L-1
)mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.化学键的极性越大,键就越强
B.凡能形成氢键的物质,其熔、沸点比同类物质的熔、沸点高
C.CFH3分子中,既有H原子,又有电负性大、半径小的F原子,因此,CFH3分子间可以形成氢键
D.稀有气体能在温度充分降低时液化,而且随相对分子质量的增大熔点升高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列数据是对应物质的熔点:
| Na2O | NaCl | AlF3 | AlCl3 |
| 920 | 801 | 1 291 | 190 |
| BCl3 | Al2O3 | CO2 | SiO2 |
| -107 | 2 073 | -57 | 1 723 |
据此作出的下列判断中错误的是( )
A.铝的化合物的晶体中有的是离子晶体 B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体 D.不同族元素的氧化物可形成相同类型的晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期表中的位置如下图所示:
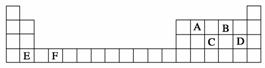
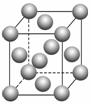
(1)写出F的基态原子核外电子排布式: 。E的晶胞结构如上图所示,该晶胞中含有金属原子的数目为________。
(2)C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是____________________________。
(3)由A、B、D三种元素形成的一种物质俗称光气,分子中A原子采取sp2杂化成键。光气分子的结构式是________,其中碳氧原子之间的共价键是________(填序号):
a.2个σ键
b.2个π键
c.1个σ键、1个π键
(4)
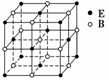
EB晶胞
EB晶胞如右图所示,EB晶体中E2+的配位数为____________,EB晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:EB-3 401 kJ·mol-1、NaCl-786 kJ·mol-1。导致两者晶格能差异的主要原因是____________________________________________。
(5)元素A形成的单质的晶体类型可以是原子晶体,如________(填写物质名称),也可以是________,如C60。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是检验某无色气体A是SO2和CO2的混合气体的装置图,按要求回答下列问题。
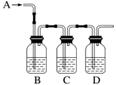
(1)B中加入的试剂是________,作用是______________________________________________。
(2)C中加入的试剂是__________,作用是__________________________________________。
(3)D中加入的试剂是________,作用是___________________________________________。
(4)实验时,C中应观察到的现象是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用下面的方案进行某些离子的检验,其中方案设计最严密的是( )
A.检验试液中的SO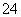 :试液
:试液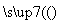 无沉淀
无沉淀 白色沉淀
白色沉淀
B.检验试液中的SO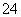 :试液
:试液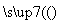 无沉淀
无沉淀 白色沉淀
白色沉淀
C.检验试液中的I-:试液 深黄色溶液
深黄色溶液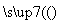 深黄色溶液
深黄色溶液
D.检验试液中的CO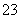 :试液
:试液 白色沉淀
白色沉淀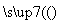 沉淀溶解
沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关硫元素及其化合物的说法或描述正确的是( )
A.硫黄矿制备硫酸经历两步:S SO3
SO3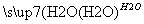 H2SO4
H2SO4
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少SO2排放,发生的反应为2CaCO3+2SO2+O2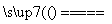 2CO2+2CaSO4
2CO2+2CaSO4
D.土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的  ,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。
,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。
请回答下列问题:
(1)B单质的电子式是________。
(2)A、B、C、E可形成两种酸式盐(均由四种元素组成),两种酸式盐相互反应的离子方程式为____________________________。
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com