

分析 (1)氯气通入氢氧化钾溶液在70℃~80℃发生反应生成氯酸钾、氯化钾和水;若有少量MnO2进入试管B,则会生成K2MnO4,依据氧化还原反应分析可知二氧化锰做氧化剂在碱性溶液中氧化氯气生成氯化钾,结合原子守恒配平书写化学方程式;
(2)制备NaClO需在0℃~5℃进行,温度控制可以用冰水混合物,温度过高还会生成NaClO3,当n(NaClO):n(NaClO3)=1:a时,依据氧化还原反应电子守恒计算;
(3)实验过程分析氯气和30%氢氧化钾溶液反应在70℃~80℃发生反应生成氯酸钾、氯化钾和水,在0℃~5℃氯气和8%KOH溶液反应生成氯化钾、次氯酸钾和水;
(4)溶解度图象分析可知同一温度下,KCl溶解度比KClO3大.
解答 解:(1)氯气通入氢氧化钾溶液在70℃~80℃发生反应生成氯酸钾、氯化钾和水,反应的离子方程式为:3Cl2+6OH-=5Cl-+ClO3-+3H2O,若有少量MnO2进入试管B,则会生成K2MnO4,依据氧化还原反应分析可知二氧化锰做氧化剂在碱性溶液中氧化氯气生成氯化钾,反应的化学方程式为:Cl2+4KOH+MnO2=K2MnO4+2KCl+2H2O,
故答案为:3Cl2+6OH-=5Cl-+ClO3-+3H2O;Cl2+4KOH+MnO2=K2MnO4+2KCl+2H2O;
(2)制备NaClO需在0℃~5℃进行,实验中宜采取的措施是将装置C放在冰水浴中,温度过高还会生成NaClO3,当n(NaClO):n(NaClO3)=1:a时,依据氧化还原反应电子守恒:(3a+1)Cl2+(6a+2)KOH=aKClO3+KClO+(5a+1)KCl+(3a+1)H2O),该反应中n(Cl2):n(NaOH)=1:2,
故答案为:将装置C放在冰水浴中;1:2;
(3)实验过程分析氯气和30%氢氧化钾溶液反应在70℃~80℃发生反应生成氯酸钾、氯化钾和水,在0℃~5℃氯气和8%KOH溶液反应生成氯化钾、次氯酸钾和水,温度不同、碱溶液浓度不同,生成产物不同,
故答案为:碱溶液(或反应物)的浓度不同,反应温度不同;
(4)KClO3、KCl的溶解度曲线分析可知同一温度下,KCl溶解度比KClO3大,反应结束后,从装置B中获得氯酸钾晶体的实验方案是冷却结晶,过滤洗涤,
故答案为;冷却结晶,过滤洗涤.
点评 本题考查了氯元素的化合物制备,反应物浓度不同,反应温度不同得到反应产物不同、化学方程式书写和氧化还原反应电子守恒等,注意氯气和碱溶液反应产物的判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 30 g乙烷中所含的极性共价键数为7NA | |
| B. | 常温常压下,28g乙烯与丁烯的混合气体含有的碳原子数目NA | |
| C. | 密闭容器中2molNO与1molO2充分反应,产物的分子数小于2NA | |
| D. | 标准状况下,22.4L HF含有的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水果表面喷洒驱虫剂不招苍蝇 | B. | 自来水使用氯制剂以杀菌消毒 | ||
| C. | 牛肚用甲醛浸泡使其口感更好 | D. | 生豆芽时用植物生长激素提高产量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳分子的比例模型: | |
| B. | 羟基可以表示为:-OH 或 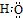 | |
| C. | 氯离子(Cl-)的结构示意图: | |
| D. | NaHSO4熔融时的电离方程式:NaHSO4=Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O | |
| B. | 充电时每转移2 mol电子,阴极有1 mol Cd(OH)2被氧化 | |
| C. | 放电时负极附近溶液的碱性不变 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
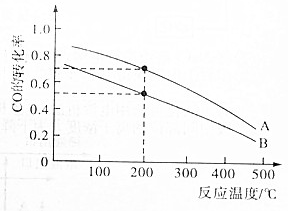 高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题.
高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 | |
| ① | ${\;}_{19}^{40}$K | 19 | 21 | 19 | 40 |
| ② | 3818Ar | 18 | 20 | 18 | 38 |
| ③ | 3216S2- | 16 | 16 | 18 | 32 |
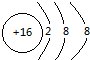 Mg2+
Mg2+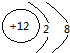 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C |
| D |
| A. | C的非金属性最强,可分别与A、E元素形成离子化合物 | |
| B. | 元素D可形成三种常见的酸,且酸根离子均能促进水的电离 | |
| C. | C单质可以从D、E组成的化合物的水溶液中置换出D | |
| D. | 离子半径由大到小的顺序为:D>E>A>B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
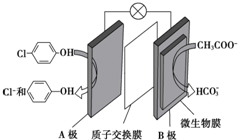 含乙酸钠和对氯酚(
含乙酸钠和对氯酚(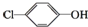 )的废水可以利用微生物电池除去,其原理如图所示,下列有关说法不正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示,下列有关说法不正确的是( )| A. | 电极B是负极 | |
| B. | 质子从A极移向B极 | |
| C. | B极的电极反应式:CH3COO--8e-+4H2O═2HCO3-+9H+ | |
| D. | 处理后的废水pH降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com