
分析 (1)金属镁和硝酸反应生成硝酸镁、水以及一氧化氮,其中Mg失去2个电子,N原子得到3个,电子根据电子守恒、原子守恒来配平方程式,并表示电子转移情况;
(2)化合价降低元素所在的反应物是氧化剂,化合价降低元素所在的产物是还原产物;
(3)根据硝酸对应的产物和其中氮元素的化合价变化确定硝酸的作用;
(4)根据方程式结合电子转移的情况和一氧化氮之间的量的关系进行计算即可.
解答 解:(1)属镁和硝酸反应生成硝酸镁、水以及一氧化氮,其中Mg失去2个电子,N原子得到3个,电子根据电子守恒、原子守恒,金属镁前边的系数是3,硝酸镁系数是3,一氧化氮的系数是2,所以硝酸的前边系数是8,水的前边系数是4,3CMg+8HNO3(稀)═3Mg(NO3)2+2NO↑+4H2O,化合价变化值=电子转移数=6,电子转移如下: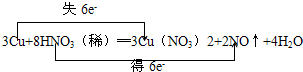 ,故答案为:
,故答案为: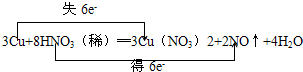 ;
;
(2)化合价降低N元素所在的反应物HNO3是氧化剂,化合价降低N元素所在的产物NO是还原产物,故答案为:稀HNO3;NO;
(3)HNO3在上述反应中显示出来的性质是酸性和氧化性,故选:AC;
(4)反应转移电子6mol,生成一氧化氮是2mol,当转移1.806×1023个即0.3mol电子时,生成的NO是0.1mol,标况下气体的体积0.1mol×22.4L/mol=2.24L,故答案为:2.24L.
点评 本题考查了化学方程式的书写、氧化还原反应方程式配平,明确反应实质是解题关键,氧化还原方程式配平时应注意得失电子守恒、原子个数守恒规律的应用.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{b}{2a}$ | B. | $\frac{a}{2b}$ | C. | $\frac{2b}{a}$ | D. | $\frac{2a}{b}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每断裂1mol H-H键的同时断裂1mol I-I键 | |
| B. | 每断裂1mol I-I键的同时生成2mol H-I键 | |
| C. | 每消耗1molH2的同时消耗2molHI | |
| D. | 压强不发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 15 | 30 | 45 | 60 | 90 | 120 | |
| 滤纸的 颜色 变化 | 玻璃片(Ⅰ) 上的滤纸 | 白色 | 白色 | 灰色 | 浅蓝色 | 蓝色 | 蓝色 | 浅蓝色 |
| 玻璃片(Ⅱ) 上的滤纸 | 白色 | 白色 | 白色 | 白色 | 灰色 | 灰色 | 浅蓝色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| I1 | I2 | I3 | I4 | … |
| 783 | 1451 | 7733 | 10540 | … |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氟及其化合物的发现史充满艰辛,现在氟及其化合物在生产生活中被广泛使用,造福人类.
氟及其化合物的发现史充满艰辛,现在氟及其化合物在生产生活中被广泛使用,造福人类.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 1.0 mo1•L-1的NaAlO2 水溶液中含有的氧原子数为2 NA | |
| B. | 常温下,30 g SiO2晶体中含有Si-O键的数目为NA | |
| C. | 标准状况下,2.24 LCl2与足量水反应转移的电子数为0.2NA | |
| D. | V L a mol•L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA | |
| B. | 标况下,11.2L SO3所含的分子数目为0.5 NA | |
| C. | 5.6克铁粉与硝酸反应失去的电子一定为0.3NA | |
| D. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O.已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
.反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O.已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com