
| A. | 世博会前期,处理废水时加入明矾可作为混凝剂可以为饮用水消毒 | |
| B. | 世博会期间,用二氧化硅制造的太阳能电池,节能减排 | |
| C. | 世博会中国馆--“东方之冠”使用的钢筋混凝土属于有机高分子化合物 | |
| D. | 世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 燃烧硫生成SO3 | B. | SO3与水反应生成H2SO4 | ||
| C. | SO2氧化成SO3需要使用催化剂 | D. | 主要设备是沸腾炉、接触室、吸收塔 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
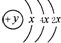 ,B、C可形成离子化合物B3C2,B离子与C离子具有相同的电子层结构,D的气态氢化物H2D的还原性较强.
,B、C可形成离子化合物B3C2,B离子与C离子具有相同的电子层结构,D的气态氢化物H2D的还原性较强. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H=-1141.8kJ/mol | B. | △H=+260.4kJ/mol | ||
| C. | △H=+441.8kJ/mol | D. | △H=-260.4kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
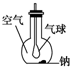 如图所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到钠表面变暗,气球膨胀,发生反应的化学方程式为4Na+O2═2Na2O.
如图所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到钠表面变暗,气球膨胀,发生反应的化学方程式为4Na+O2═2Na2O.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
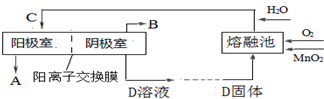
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
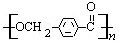 的路线:
的路线: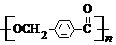
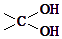 →
→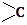 ═O+H2O
═O+H2O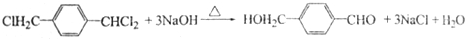 ;该反应过程中生成的不稳定中间体的结构简式应是
;该反应过程中生成的不稳定中间体的结构简式应是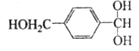 .
.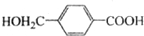 ,D的同分异构体中含有苯环且水解产物之一为乙酸的有3种,写出其中的一种结构简式:
,D的同分异构体中含有苯环且水解产物之一为乙酸的有3种,写出其中的一种结构简式: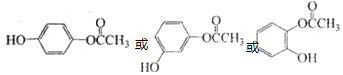 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com