

| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
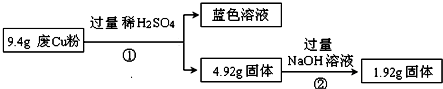
分析 过程Ⅰ:工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种),由图1可知,9.4gCu粉和过量稀硫酸反应生成蓝色溶液,所以是铜离子的颜色,但是金属Cu和盐酸不反应,所以一定含有氧化铁,和盐酸反应生成的三价铁离子可以和金属铜反应,二氧化硅可以和氢氧化钠反应,4.92g固体和氢氧化钠反应后,固体质量减少了3.0g,所以该固体为二氧化硅,质量为3.0g,涉及的反应有:Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=2Fe2++Cu2+、SiO2+2NaOH=Na2SiO3+H2O,又Cu与NaOH不反应,1.92g固体只含Cu;
过程Ⅱ:由图可知,9.4gX与过量的氢氧化钠溶液反应后得到6.4g不溶物,固体部分溶解,原固体中至少含有Al2O3、SiO2的一种物质;6.4g固体与过量的稀硫酸反应得到蓝色溶液,蓝色溶液中存在铜离子,发生了反应:Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,说明溶液中一定存在Fe2+、H+、Cu2+,1.92g固体为铜,以此来解答;
(4)Ⅱ中所得蓝色溶液存在Fe2+、H+、Cu2+,向其中加入一定量的H2O2 溶液,发生氧化还原反应,亚铁离子被氧化成铁离子,调节pH值,使铁离子沉淀完全,根据表中的数据判断pH值;
A.H2O2被还原后生成水,是绿色氧化剂,在氧化过程中不引进杂质、不产生污染;
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2完全沉淀时的pH是9.6,而Fe(OH)3完全沉淀时的pH为4.0,据此判断;
C.调节溶液pH选择的试剂要能与硫酸反应且不引入新杂质,溶液中的溶质主要是硫酸铜,据此判断;
D.根据表中的数据可知,在pH>4的溶液中Fe3+已经沉淀完全.
解答 解:过程Ⅰ:工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种),由图1可知,9.4gCu粉和过量稀硫酸反应生成蓝色溶液,所以是铜离子的颜色,但是金属Cu和盐酸不反应,所以一定含有氧化铁,和盐酸反应生成的三价铁离子可以和金属铜反应,二氧化硅可以和氢氧化钠反应,4.92g固体和氢氧化钠反应后,固体质量减少了3.0g,所以该固体为二氧化硅,质量为3.0g,涉及的反应有:Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=2Fe2++Cu2+、SiO2+2NaOH=Na2SiO3+H2O,又Cu与NaOH不反应,1.92g固体只含Cu,
(1)根据上面的分析,废Cu粉中一定含有的杂质是 Fe2O3、SiO2,
故答案为:Fe2O3、SiO2;
(2)由I可知X中一定存在的是Cu、Fe2O3、Al2O3,离子方程式分别为Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,③涉及反应有SiO2+2OH-═SiO32-+H2O、Al2O3+2OH-=2AlO2-+H2O,
故答案为:Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、Cu+2Fe3+═2Fe2++Cu2+;SiO2+2OH-═SiO32-+H2O、Al2O3+2OH-=2AlO2-+H2O;
过程Ⅱ:由图可知,9.4gX与过量的氢氧化钠溶液反应后得到6.4g不溶物,固体部分溶解,原固体中至少含有Al2O3、SiO2的一种物质;6.4g固体与过量的稀硫酸反应得到蓝色溶液,蓝色溶液中存在铜离子,发生了反应:Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,总反应为Fe2O3+6H++Cu═2Fe2++Cu2++3H2O,根据该反应可知,参加反应的,未溶解的1.92g固体为铜,
(3)由第一个流程可知二氧化硅的质量为3.0g,第二个流程中9.4gX与过量的氢氧化钠溶液反应后得到6.4g不溶物,固体质量减少3g,则原固体中只含有SiO2,没有Al2O3,
则Fe2O3、Cu一共6.4g,设Fe2O3为xmol,Cu为ymol,
则160x+64y=6.4
Fe2O3+6H++Cu═2Fe2++Cu2++3H2O,
xmol xmol 2xmol xmol
则反应剩余的Cu为:(y-x)mol×64g/mol=1.92g,
解得:x=0.02,y=0.05,
则Fe2O3的质量为0.02mol×160g/mol=3.2g,
Cu的质量为0.05mol×64g/mol=3.2g,
原混合物中各成分的质量之比m(Fe2O3):m(Cu):m(SiO2)=3.2:3.2:3.0=16:16:15,
故答案为:m(Fe2O3):m(Cu):m(SiO2)=16:16:15;
(4)Ⅱ中所得蓝色溶液存在Fe2+、H+、Cu2+,向其中加入一定量的H2O2 溶液,发生氧化还原反应,亚铁离子被氧化成铁离子,调节pH值,使铁离子沉淀完全,根据表中的数据可知,当pH值为4.0时,铁离子沉淀完全,当pH值为5.4时,铜离子开始沉淀,所以要使得铁离子完全沉淀,而铜离子不能沉淀,调节pH值为4.0≤pH<5.4,
故答案为发:4.0≤pH<5.4;
A.H2O2被还原后生成水,是绿色氧化剂,在氧化过程中不引进杂质、不产生污染,故A正确;
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2完全沉淀时的pH是9.6,而Fe(OH)3完全沉淀时的pH为4.0,故B错误;
C.调节溶液pH选择的试剂要能与硫酸反应且不引入新杂质,溶液中的溶质主要是硫酸铜,故C正确;
D.根据表中的数据可知,在pH>4的溶液中Fe3+已经沉淀完全,故D正确,
故选ACD.
点评 本题考查物质分离提纯的综合应用,侧重于学生的分析和实验能力的考查,为高考常见题型和高频考点,注意掌握检验未知物的常用方法,能够根据反应现象判断存在的物质,注意合理分析题中数据,根据题中数据及反应方程式计算出铜和氧化铁的质量,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测稀碱液的pH值,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时仰视刻度线,所配溶液浓度偏大 | |
| C. | 用盐酸标准溶液滴定未知浓度的NaOH溶液时,若滴定前滴定管内无气泡,终点读数时有气泡,则所测NaOH溶液的浓度偏大 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.30 | B. | 0.35 | C. | 0.40 | D. | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
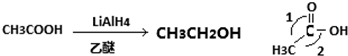
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
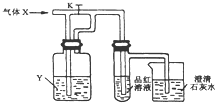
| A. | X是SO2,Y是饱和NaHCO3 溶液 | B. | X是H2S,Y是浓H2SO4 | ||
| C. | X是CO2,Y是Na2SO3 溶液 | D. | X是Cl2,Y是Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、K+、HCO3-、Ca2+ | B. | OH-、NH4+、Mg2+、HCO3- | ||
| C. | SO32-、H+、Cl-、NO3- | D. | Na+、SiO32-、H+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com