
| A. | 5:3:2 | B. | 3:2:2 | C. | 5:4:1 | D. | 3:2:1 |
分析 电解质混合溶液呈电中性,由电荷守恒可知:c(Na+)=c(Br-)+c(Cl-),结合选项验证解答.
解答 解:电解质混合溶液呈电中性,由电荷守恒可知:c(Na+)=c(Br-)+c(Cl-).
A.Na+、Br-、Cl-的物质的量浓度之比为5:3:2,满足c(Na+)=c(Br-)+c(Cl-),故A不选;
B.Na+、Br-、Cl-的物质的量浓度之比为3:2:2,则c(Na+)≠c(Br-)+c(Cl-),故B选;
C.Na+、Br-、Cl-的物质的量浓度之比为5:4:1,满足c(Na+)=c(Br-)+c(Cl-),故C不选;
D.Na+、Br-、Cl-的物质的量浓度之比为3:2:1,满足c(Na+)=c(Br-)+c(Cl-),故D不选,
故选:B.
点评 本题考查物质的量浓度有关计算,难度不大,注意电解质混合溶液中常利用电荷守恒进行离子浓度计算.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,可制成玻璃容器盛装氢氟酸 | |
| B. | 氧化铁为红棕色固体,可用于作油漆红色涂料 | |
| C. | 次氯酸有酸性,可用于自来水的杀菌消毒 | |
| D. | 钠具有金属活泼性,钠可以从硫酸铜溶液中置换出金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
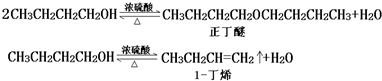
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |
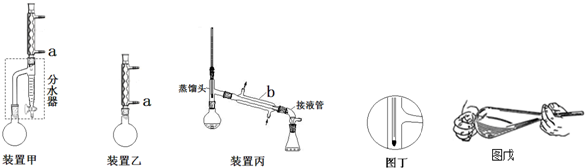

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热的方法区分纯碱和小苏打 | |
| B. | 用量筒量取5.0mL浓硫酸,并直接加水稀释 | |
| C. | 用分液漏斗分离苯和水的混合物 | |
| D. | 用托盘天平称量药品时,左盘放物品,右盘放砝码 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅的导电性介于金属和绝缘体之间,是良好的半导体 | |
| B. | 加热到一定温度时,硅能与氯气、氧气等非金属反应 | |
| C. | 利用二氧化硅与C反应能制得粗硅 | |
| D. | 二氧化硅性质较稳定,常温下不与任何物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com