
分析 用Zn+2H+═Zn2++H2↑的反应设计原电池,该原电池中负极材料为金属锌,正极材料可以为铜棒或活泼性比锌若的其它金属材料,电解质溶液为稀硫酸或者稀盐酸,则该原电池装置图如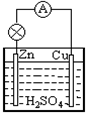 ,以此来解答.
,以此来解答.
解答 解:(1)根据反应Zn+2H+═Zn2++H2↑可知,电解质溶液为非氧化性强酸,可以选用稀硫酸或者稀盐酸,
故答案为:稀硫酸(或稀盐酸);
(2)反应Zn+2H+═Zn2++H2↑中,锌在负极失去电子生成锌离子,负极反应为Zn-2e-═Zn2+;氢离子在正极得到电子生成氢气,正极反应为2H++2e-═H2↑,
故答案为:Zn-2e-═Zn2+;2H++2e-═H2↑.
点评 本题考查原电池的设计,为高频考点,把握电池反应与电极反应、电极判断为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应与原电池的联系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 无论是风力发电还是火力发电,都是将化学能转化为电能 | |
| B. | PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 | |
| C. | 硫的氧化物和氮的氧化物是形成酸雨的主要物质 | |
| D. | “无磷洗涤剂”的推广使用,不能有效减少水体富营养化的发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知CsCl晶体的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( )
已知CsCl晶体的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( )| A. | NA•a3•ρ | B. | $\frac{{{N_A}•{a^3}•ρ}}{6}$ | C. | $\frac{{{N_A}•{a^3}•ρ}}{4}$ | D. | $\frac{{{N_A}•{a^3}•ρ}}{8}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子晶体 | 分子晶体 | 原子晶体 | 金属晶体 |
| A | NH4Cl | SO3 | SiC | K |
| B | H2SO4 | 硫 | 石墨 | Fe |
| C | NaOH | 甲烷 | Ar | Cu |
| D | Na2O | 玻璃 | 金刚石 | Mg |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | H2C2O4 | HCN | H2CO3 |
| 电离常数(25℃) | K1=5.4×10-2 K2=5.4×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
| A. | NaCN+H2O+CO2(少量)=HCN+NaHCO3 | |
| B. | 0.1mol•L-1的Na2CO3溶液逐渐滴加到同浓度的HCN溶液中,无现象,说明未发生反应 | |
| C. | 浓度均为0.1mol•L-1的Na2CO3、NaHCO3、NaCN、NaHC2O4溶液,pH最大的是NaCN | |
| D. | NaHC2O4溶液中,离子浓度由大到小的顺序是 c(Na+ )>c(H+ )>c(HC2O4- )>c(C2O42- )>c(OH- ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 氢气 | 洗气 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | 溴苯(溴单质) | 蒸馏水 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C8H10(含苯环)的烃,同分异构体共有3种 | |
| B. |  能发生取代、加成、氧化、消去等反应 能发生取代、加成、氧化、消去等反应 | |
| C. | 油脂在一定条件下水解成高级脂肪酸和甘油,此反应称为皂化反应 | |
| D. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com