
| y |
| 4 |
| y |
| 4 |
| 点燃 |
| y |
| 2 |
| y |
| 4 |
| 点燃 |
| y |
| 2 |
| y |
| 4 |
| y |
| 4 |
| 点燃 |
| y |
| 2 |
| y |
| 4 |
| y |
| 2 |
| y |
| 4 |
| y |
| 4 |
| 点燃 |
| y |
| 2 |
| y |
| 4 |
| y |
| 4 |
| y |
| 4 |
| y |
| 4 |


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
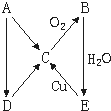 如右所示A、B、C、D、E变化关系网,均省去了反应所需条件,
如右所示A、B、C、D、E变化关系网,均省去了反应所需条件, 查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
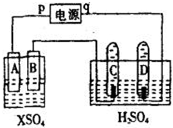 图中p、q为直流电源两极,A极由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
图中p、q为直流电源两极,A极由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极气体体积(cm3) | 6 | 12 | 20 | 29 | 32 | 42 | 52 | 62 | 72 | 82 |
| 阳极气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 2l | 26 | 3l | 36 | 41 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知:在298K、1.01KPa下,由稳定的单质发生反应生成1mol气态化合物的反应热叫该化合物的生成热(△H).如图所示为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:请你归纳出非金属元素氢化物的稳定性与其反应热△H的关系
(1)已知:在298K、1.01KPa下,由稳定的单质发生反应生成1mol气态化合物的反应热叫该化合物的生成热(△H).如图所示为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:请你归纳出非金属元素氢化物的稳定性与其反应热△H的关系查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯中的少量苯酚可先加适量的浓溴水,再过滤而除去 |
| B、苯酚晶体易溶于水 |
| C、苯酚的酸性很弱,不能使酸碱指示剂变色,但可以和NaHCO3反应放出CO2 |
| D、苯酚有毒,但其稀溶液可直接用作防腐剂和消毒剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com