
| A. | Cl-的结构示意图: | |
| B. | 硝基苯的结构简式: | |
| C. | 乙烯的结构式: | |
| D. | 氢元素有三种核素:${\;}_{1}^{1}H$、${\;}_{1}^{2}$D、${\;}_{1}^{3}$T |
分析 A.氯离子核外含有3个电子层,核外电子总数为18,图示为氯离子的电子式;
B.硝基书写不规范,不是碳氧键;
C.乙烯的分子式C2H4,两个碳原子之间通过共用2对电子形成一个碳碳双键;
D.H、D、T为氢元素的3种不同核素,${\;}_{1}^{2}$D、${\;}_{1}^{3}$T书写错误.
解答 解:A.Cl-的质子数为17,电子数为18,离子结构示意图为: ,故A错误;
,故A错误;
B.硝基写在苯环的左边时,应该表示为;O2N-,硝基苯正确的结构简式为: ,故B错误;
,故B错误;
C.乙烯分子中含有2个碳原子和4个氢原子,两个碳原子之间通过共用2对电子形成一个碳碳双键,其电子式为: ,结构式为:
,结构式为: ,故C正确;
,故C正确;
D.${\;}_{1}^{2}$D、${\;}_{1}^{3}$T书写错误,氢元素有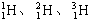 三种核素,故D错误;
三种核素,故D错误;
故选C.
点评 本题考查了常见化学用语的书写,题目难度不大,涉及离子结构示意图、结构简式、结构式、氢元素的三种核素等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的分析、理解能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 250 | 310 | 350 |
| K/(mol•L-1)-2 | 2.041 | 0.250 | 0.012 |
| 浓度mol•L-1 时间/min | C(CO) | C(H2) | C(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有Fe3+大量的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 某无色透明溶液:NH4+、K+、SO32-、Cr2O72- | |
| C. | 在c(H+)=0.1mol/L的溶液中:K+、Mg2+、Cl-、NO3- | |
| D. | 在能与Al反应产生H2的溶液中:NH4+、NO3-、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+H2$\stackrel{催化剂}{→}$C2H6 | |
| B. | 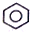 +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$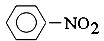 +H2O +H2O | |
| C. | CH3COOCH2CH3+H2O$→_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
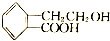 的有机物可以通过不同的反应得到下列五种物质
的有机物可以通过不同的反应得到下列五种物质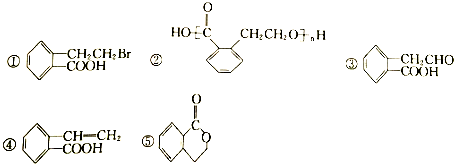
| A. | 取代、加成、氧化、消去、取代 | B. | 取代、取代、还原、消去、酯化 | ||
| C. | 酯化、缩聚、取代、消去、取代 | D. | 取代、缩聚、氧化、消去、酯化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com