
某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数,下列说法中正确的是( )
①氯元素的相对原子质量一定是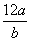 ②m g该氯原子的物质的量一定是
②m g该氯原子的物质的量一定是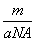 mol ③该氯原子的摩尔质量是aNA g/mol ④a g该氯原子所含质子数是17 mol
mol ③该氯原子的摩尔质量是aNA g/mol ④a g该氯原子所含质子数是17 mol
A.①③ B.②④
C.①④ D.②③
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
现代化学工业遵循可持续发展原则,利用淀粉、纤维素等可再生资源合成多种化工产品。
(1)以淀粉为原料可制取香料乙酸乙酯,生产流程为
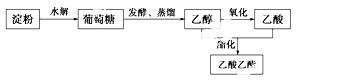
①部分链状葡萄糖分子在水溶液中通过分子内加成 反应,以六元环或五元环的形式存在,其中六元环的结构为
反应,以六元环或五元环的形式存在,其中六元环的结构为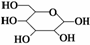 ,则葡萄糖在水溶液存在的五元环结构为
,则葡萄糖在水溶液存在的五元环结构为
________________________________________________________________________。
②若用1 000 kg含(C6H10O5)n 90%的淀粉(杂质不参与反应)为原料制取乙酸乙酯。生产中,淀粉的水解率为90%,乙醇的产率为85%,酯化反应中乙醇、乙酸的转化率均为90%。生产中得到的乙酸乙酯的质 量为________kg。
量为________kg。
(2)纤维素的结构可表示为[(C6H7O2)(OH)3]n。10.00 g脱脂棉花(纤维素含量为100%)与乙酸、乙酸酐[(CH3CO)2O]的混合物在一定条件下发生酯化反应,可制得15.19 g醋酸纤维(纤维素乙酸酯)。请推断该醋酸纤维的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
若室温下0.1mol·L-1NaX溶液中pH=9,则该溶液中发生水解反应的X-占全部X-的( )
A.0.01% B. 0.09%
C.1.0% D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学欲从溶有苯酚的乙醇中回收苯酚,设计了实验方案,其流程如下,试回答下列问题。
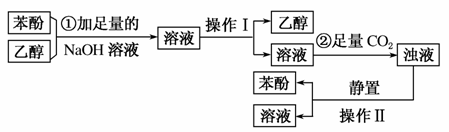
(1)①中加入NaOH溶液后发生的化学反应方程式:__________________________________________。
(2)操作Ⅰ为________,操作Ⅱ为________。
(3)②中通入CO2后发生的化学反应方程式为:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值 ,下列说法正确的是( )
,下列说法正确的是( )
A.常温常压下,16 g O3气体含有氧原子数为NA
B.标准状况下,44.8 L四氯化碳含有的分子数为2NA
C.0.1 mol·L-1氯化铝溶液中含有Al3+数为0.1NA
D.2.4 g金属镁变为镁离子时失去的电子数为0. 1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.25 ℃时,pH=13的氨水中含有OH-的数目为0.1 NA
B.标准状况下,2.24 L NO2与水反应生成NO 的数目为0.1 NA
的数目为0.1 NA
C.1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA
D.4.0 g H2与足量O2完全反应生成水,反应中断裂共价键的总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
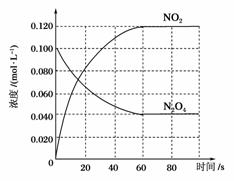
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深 。
。
回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为__________mol·L-1·s-1,反应的平衡常数K1为______________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是______________________________。
②列式计算温度T时反应的平衡常数K2______________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由______________________________________________________ ___________ _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气中NOx的消除及无害化处理引起社会广泛关注。
(1)某兴趣小组查阅文献获得如下信息:
N2(g)+ O2(g)= 2NO(g) △H= + 180.5 kJ/mol
2H2(g)+ O2(g)= 2H2O(g) △H= - 483.6 kJ/mol
则反应2H2(g)+ 2NO(g) = 2H2O(g) + N2(g) △H=________。
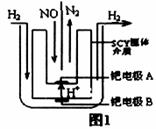 (2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。钯电极A为____极,电极反应式为_______________。
(2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。钯电极A为____极,电极反应式为_______________。
(3)污染物NO、NO2也可以用烧碱溶液吸收,生成物中无气体,该反应的离子方程式为______________________________________________。只有NO2也能与NaOH溶液反应,生成NaNO2 和NaNO3 。现用某烧碱溶液完全吸收n mol NO2和m mol NO组成的混合气体,若所得溶液中c(NO3-): c(NO2-) = 1:9,则原混合气体中NO2和NO的物质的量之比n:m =_______________ 。
(4)下列有关含氮元素溶液的说法正确的是______________
A.c(NH4+)相等的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液中,
c[(NH4)2Fe(SO4)2] > c[(NH4)2SO4]>c[(NH4)2CO3]
B.常温下,等体积的pH=13的NaOH溶液和pH=1的HNO2溶液混合,所得溶液中
c(Na+)>c(NO2—)>c(OH—)>c(H+)
C.某溶液中只存在OH—、H+、Cl—、NH4+四种离子,其离子浓度c(NH4+)>c(Cl—)>c(OH—)>c(H+),则溶液中c(NH3·H2O) + c(NH4+)>c(Cl—)
D.将NH4Cl溶液蒸干制备NH4Cl固体
E.施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用,是因为K2CO3与NH4Cl反应生成氨气会降低肥效
F.反应NH3(g)+HCl(g)=== NH4Cl(s)在室温下可自发进行,则该反应的△H<0
(5) NO2可用氨水吸收生成NH4NO3。25℃时,将a mol NH4NO3溶于水,溶液显酸性、原因是
(用离子方程式表示)。向该溶液滴加氨水至溶液b L时呈中性,则滴加氨水的过程中水的电离平衡将 (填“正向”“不”或“逆向”)移动,所得溶液中氨水的浓度为 mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)
(6)在恒容密闭容器中,氨基甲酸铵(NH2COONH4)分解反应:
NH2COONH4(s)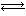 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
① 可以判断该分解反应已经达到平衡的是 。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
② 取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量是 (填“增大”,“减小”或“不变”),平衡常数_________(填“增大”,“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com