
| 10g-6.3g |
| 10g |


科目:高中化学 来源: 题型:
| A、H2Y的电离方程式为:H2Y=2H++Y2- |
| B、在该酸式盐溶液中:[Na+]>[Y2-]>[HY-]>[OH-]>[H+] |
| C、HY-的水解方程式:HY-+H2O?H3O++Y2- |
| D、在该酸式盐溶液中:[Na+]>[HY-]>[OH-]>[H+]>[Y2-] |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
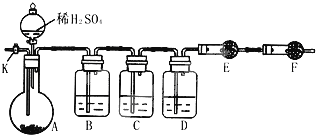
 纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.
纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.查看答案和解析>>
科目:高中化学 来源: 题型:
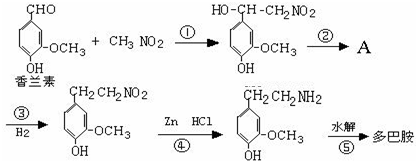
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁强化酱油可通过膳食补充人体所需的铁元素 |
| B、变质的植物油有难闻的特殊气味,是由于植物油发生了水解反应 |
| C、一定浓度的双氧水可用于伤口的消毒 |
| D、蔬菜中含有维生素C,生吃新鲜蔬菜要比熟吃时维生素C的损失大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
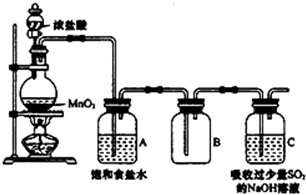 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4溶液至溶液呈酸性,然后将所得溶液分别置于A、B试管中 | / |
| 步骤2: | Ⅰ: Ⅱ: |
| 步骤3: | Ⅰ: Ⅱ: |
查看答案和解析>>
科目:高中化学 来源: 题型:
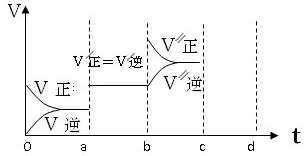 在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:| 物 质 | A | B | C |
| 初始浓度/mol?L-1 | 1.0 | 2.0 | 0 |
| 2min时,平衡浓度/mol?L-1 | 0.4 | 0.2 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ |
| B、只有①②③ |
| C、只有①②③④ |
| D、只有①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com