
【题目】已知某弱酸的酸式盐有NaH2XO4和Na2HXO4两种,其中NaH2XO4的溶液呈酸性,Na2HXO4溶液呈碱性。30℃时,NaH2XO4溶液和Na2HXO4溶液,二种溶液的浓度均为0.1mol·L-1,其中均存在的关系是( )
A.c(H+)·c(OH-)=1×10-14
B.c(H+)+2c(H3XO4)+c(H2XO4-)=c(XO43-)+c(OH-)
C.c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-)
D.c(H+)+c(H3XO4)=c(HXO42-)+2c(XO43-)+c(OH-)
【答案】C
【解析】
NaH2XO4的溶液呈酸性,说明![]() 电离程度大于水解程度,Na2HXO4溶液呈碱性,说明
电离程度大于水解程度,Na2HXO4溶液呈碱性,说明![]() 水解程度大于电离程度,溶液中存在物料守恒,0.1molL-1NaH2XO4溶液中存在:c(Na+)=c(
水解程度大于电离程度,溶液中存在物料守恒,0.1molL-1NaH2XO4溶液中存在:c(Na+)=c(![]() )+c(
)+c(![]() )+c(
)+c(![]() )+c(H3XO4),Na2HXO4溶液中存在:c(Na+)=2c(
)+c(H3XO4),Na2HXO4溶液中存在:c(Na+)=2c(![]() )+2c(
)+2c(![]() )+2c(
)+2c(![]() )+2c(H3XO4),由溶液呈电中性原则可知,c(Na+)+c(H+)=c(
)+2c(H3XO4),由溶液呈电中性原则可知,c(Na+)+c(H+)=c(![]() )+c(OH-)+2c(
)+c(OH-)+2c(![]() )+3c(
)+3c(![]() ),结合物料守恒和电荷守恒联式比较,注意水的离子积常数与温度的关系。
),结合物料守恒和电荷守恒联式比较,注意水的离子积常数与温度的关系。
A.常温下c(H+)c(OH-)=1×10-14,温度升高,促进水的电离,水的离子积常数增大,则30℃时,c(H+)c(OH-)>1×10-14,故A错误;
B.溶液中存在物料守恒,0.1molL-1NaH2XO4溶液中存在:c(Na+)=c(![]() )+c(
)+c(![]() )+c(
)+c(![]() )+c(H3XO4),Na2HXO4溶液中存在:c(Na+)=2c(
)+c(H3XO4),Na2HXO4溶液中存在:c(Na+)=2c(![]() )+2c(
)+2c(![]() )+2c(
)+2c(![]() )+2c(H3XO4),由电中性原则可知,两种溶液中都存在:c(Na+)+c(H+)=c(
)+2c(H3XO4),由电中性原则可知,两种溶液中都存在:c(Na+)+c(H+)=c(![]() )+c(OH-)+2c(
)+c(OH-)+2c(![]() )+3c(
)+3c(![]() ),则有0.1molL-1NaH2XO4溶液中存在:c(H3XO4)+c(H+)=c(OH-)+c(
),则有0.1molL-1NaH2XO4溶液中存在:c(H3XO4)+c(H+)=c(OH-)+c(![]() )+2c(
)+2c(![]() ),Na2HXO4溶液中存在:c(
),Na2HXO4溶液中存在:c(![]() )+c(H+)+2c(H3XO4)=c(OH-)+c(
)+c(H+)+2c(H3XO4)=c(OH-)+c(![]() ),则只有Na2HXO4溶液中存在该关系,故B错误;
),则只有Na2HXO4溶液中存在该关系,故B错误;
C.由溶液呈电中性原则可知,溶液中阳离子所带电荷等于阴离子所带电荷,则c(Na+)+c(H+)=c(![]() )+c(OH-)+2c(
)+c(OH-)+2c(![]() )+3c(
)+3c(![]() ),故C正确;
),故C正确;
D.由B分析可知,只有0.1molL-1NaH2XO4溶液中存在该关系,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】化学实验课用KCl和NaNO3来制备KNO3的实验要用到减压过滤,下图是减压过滤的装置,请回答下列问题:

(1)写出图中A、B两种仪器的名称,
A_________________;B ___________________
(2)该装置图有几处错误,请指出B仪器处关键性的错误_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备 Cl2 的过程中有水蒸气和 HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置 ( 支撑用的铁架台省略 ),按要求回答问题.

(1)下列方法中,可制得氯气的正确组合是___.(已知酸性条件下,K2Cr2O7、KClO3的氧化性均强于Cl2;酒精灯可以不用)
①MnO2 和浓盐酸混合共热; ②次氯酸钠和浓盐酸混合;③K2Cr2O7 和浓盐酸混合; ④KClO3 和浓盐酸混合共热;⑤KMnO4和浓盐酸混合;
A 只有① B 只有①⑤ C 只有①③④⑤ D 全部可以
(2)若用含有 0.2mol HCl 的浓盐酸与足量的 MnO2 反应制 Cl2,制得的 Cl2 体积 ( 标准状况下 )总是小于1.12L的原因是___.
(3)装置 B 的作用____,现象是____.
(4)装置 C 和 D 出现的不同现象说明的问题是___、装置 E 的作用是____.
(5)写出装置 F 中发生反应的离子方程式____.
(6)乙同学认为甲同学的实验有缺陷,不能确保最终通入 AgNO3 溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入 AgNO3 溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在__与__之间 ( 填装置字母序号 ),装置中应放入___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验。请回答下列问题:
Ⅰ.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.00 g样品溶于水,配成250 mL溶液;
②准确量取25.00 mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.10 mol/L的盐酸标准液滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积mL | 所消耗盐酸标准液的体积/mL | |
滴定前读数 | 滴定后读数 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
(1)用__________滴定管(填“酸式”或“碱式”)盛装0.10 mol/L的盐酸标准液
(2)试样中NaOH的质量分数为__________
(3)若出现下列情况,测定结果偏高的是________
A.滴定前用蒸馏水冲洗锥形瓶
B.在振荡锥形瓶时不慎将瓶内溶液溅出
C.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
D.酸式滴定管滴至终点时,俯视读数
E.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定
(4)取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1 mol·L-1的高锰酸钾溶液滴定,发生的反应为2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时现象是__________
(5)用0.01 mol/L的I2标准溶液滴定未知浓度的Na2S2O3溶液,选用的指示剂是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铵[(NH4)2C2O4]为无色柱状晶体,不稳定,受热易分解,可用于测定Ca2+、Mg2+的含量。
I.某同学利用如图所示实验装置检验草酸铵的分解产物。
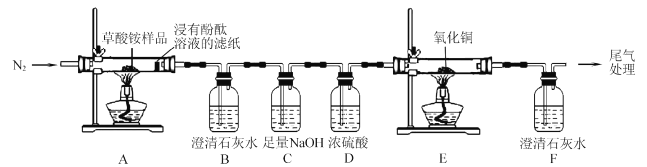
(l)实验过程中,观察到浸有酚酞溶液的滤纸变红,装置B中澄清石灰水变浑浊,说明分解产物中含有____(填化学式);若观察到____, 说明分解产物中含有CO2草酸铵分解的化学方程式为____。
(2)反应开始前,通人氮气的目的是____。
(3)装置C的作用是 ____。
(4)还有一种分解产物在一定条件下也能还原CuO,该反应的化学方程式为 _____。
Ⅱ.该同学利用草酸铵测定血液中钙元素的含量。
(5)取20. 00mL血液样品,定容至l00mL,分别取三份体积均为25. 00mL稀释后的血液样品,加入草酸铵,生成草酸钙沉淀,过滤,将该沉淀溶于过量稀硫酸中,然后用0. 0l00mol/LKMnO4溶液进行滴定。滴定至终点时的实验现象为____。三次滴定实验消耗KMnO4溶液的体积分别为0.43mL,0.4lmL,0.52mL,则该血液样品中钙元素的含量为__________ mmol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A.离子结构示意图:![]() 可以表示16O2-,也可以表示18O2-
可以表示16O2-,也可以表示18O2-
B.比例模型:![]() 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
C.氯化铵的电子式为:![]()
D.二氧化碳分子的比例模型是: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )
A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
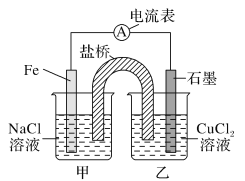
(1)如图为某实验小组依据的氧化还原反应:(用离子方程式表示)______设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为:_________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因_____。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示:
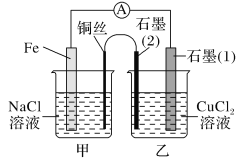
一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是_____,电极反应为______________;乙装置中与铜丝相连石墨(2)电极上发生的反应式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com