
分析 (1)根据13gC2H2气体完全燃烧生成液态水和CO2,放出659kJ的热量,计算1molC2H2燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;
(2)A、水的离子积常数与温度有关,温度越高,水的离子积常数越大;
B、根据溶液中电荷守恒判断;
C、根据题意知NaHA溶液呈酸性,Na2A溶液呈碱性,则向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的物质的量应大于氢氧化钾的物质的量;
D、根据题意知NaHA溶液呈酸性,Na2A溶液呈碱性,则向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的体积应大于KOH的体积,据此确定钠离子和钾离子浓度之和.
解答 解:(1)C2H2气体完全燃烧反应的化学方程式为:2C2H2+5O2 $\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O,13g C2H2气体n(C2H2)=$\frac{13g}{26g/mol}$=0.5mol,放出659kJ的热量,则1molC2H2燃烧放出的热量为:659kJ×2=1318KJ,则热化学方程式为:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1318KJ/mol,
故答案为:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1318KJ/mol;
(2)A、水的离子积常数与温度有关,温度越高,水的离子积常数越大,温度未知,所以水的离子积常数也未知,故A错误;
B、溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性,氢离子浓度等于氢氧根离子浓度,所以c(Na+)+c(K+)=c(HA-)+2c(A2-),故B正确;
C、NaHA溶液呈酸性,Na2A溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的物质的量应大于氢氧化钾的物质的量,所以同一混合溶液中c(Na+)>c(K+),故C正确;
D、NaHA溶液呈酸性,Na2A溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的体积应大于氢氧化钾的体积,所以c(Na+)+c(K+)>0.05mol/L,故D错误;
故答案为:BC.
点评 本题考查了热化学方程式的书写,盐溶液酸碱性的判断、溶液中离子浓度的关系、根据电荷守恒、物料守恒来分析解答即可.


科目:高中化学 来源: 题型:计算题
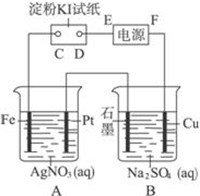 室温下,用下图所示的装置进行电解.通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.若电解结束时,A、B装置中共收集到气体1.68L(标准状况),假设电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求此时A溶液的pH值.(提示:pH=-lgc(H+))
室温下,用下图所示的装置进行电解.通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.若电解结束时,A、B装置中共收集到气体1.68L(标准状况),假设电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求此时A溶液的pH值.(提示:pH=-lgc(H+))查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量时,将胆矾晶体直接放在托盘天平的右盘上 | |
| B. | 准确称取16.0g胆矾,溶于水,待溶液恢复到室温,转移至1000mL容量瓶中,定容 | |
| C. | 准确称取25.0g胆矾,溶于水,待溶液恢复到室温,转移至1000mL容量瓶中,定容 | |
| D. | 定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H3=△H1+△H2 | B. | △H3=△H1+2△H2 | C. | △H3=2△H2-△H1 | D. | △H3=△H1-△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取28.6 g Na2CO3•10H2O,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 称取 28.6 g Na2CO3•10H2O,加入100 mL蒸馏水,搅拌、溶解 | |
| C. | 转移时将烧杯中溶液直接倒人容量瓶中 | |
| D. | 定容后,塞好瓶塞,反复倒转、摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 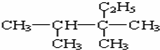 ,3,3-三甲基戊烷 ,3,3-三甲基戊烷 | B. | 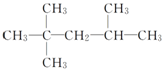 2,2,4三甲基戊烷 2,2,4三甲基戊烷 | ||
| C. | (CH3CH2)2CHCH3 3甲基戊烷 | D. | 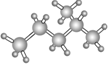 异戊烷 异戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0g H218O与T2O的混合物中所含中子数 | |
| B. | 250mL 1mol/LFeCl3溶液中,阴、阳离子总数 | |
| C. | 标准状况下,7g某单烯烃A中的C-H键数 | |
| D. | 200mL 10mol/L盐酸与足量MnO2反应,转移电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com