
| A. | Ba(OH)2+H2SO4═BaSO4↓+2H2O既是放热反应又是氧化还原反应 | |
| B. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O反应物的总能量低于生成物的总能量 | |
| C. | C(石墨)$\frac{一定条件}{\;}$C(金刚石)是吸热反应,所以金刚石比石墨更稳定 | |
| D. | 吸热反应和放热反应都遵守能量守恒定律 |
分析 A、有化合价变化的反应属于氧化还原反应;
B、甲烷的燃烧属于放热反应,生成物总能量低于反应物总能量;
C、石墨转化为金刚石为吸热反应,石墨更稳定;
D、任何反应均遵循能量守恒定律.
解答 解:A、Ba(OH)2+H2SO4═BaSO4↓+2H2O,此反应为复分解反应,不是氧化还原反应,故A错误;
B、CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,此反应为放热反应,反应物的总能量高于生成物的总能量,故B错误;
C、能量越低越稳定,C(石墨)$\frac{一定条件}{\;}$C(金刚石)是吸热反应,所以石墨比金刚石更稳定,故C错误;
D、任何反应均遵循能量守恒定律,吸热反应和放热反应也是如此,故D正确,故选D.
点评 本题主要考查的是常见吸热反应与放热反应以及能量变化规律,还考查了氧化还原反应的判断,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol 甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5mol 1,3-丁二烯分子中含有 数为NA 数为NA | |
| D. | 1mol碳正离子(CH${\;}_{3}^{+}$)所含的电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
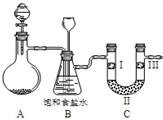 某学习小组围绕氯气设计了系列实验.
某学习小组围绕氯气设计了系列实验.| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
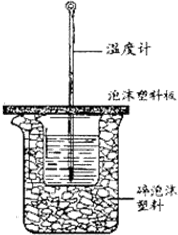 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 起始温度T1/℃ | 终止温度 T2/℃ | ||
| HCl | NaOH | ||
| 1 | 25.1 | 25.2 | 28.4 |
| 2 | 25.1 | 25.2 | 28.3 |
| 3 | 25.1 | 25.2 | 28.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏能得到石油气、汽油和煤油等清洁能源 | |
| B. | 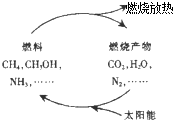 在如图循环转化过程中,太阳能最终转化为热能 | |
| C. | 煤的干馏是指将煤在空气中加热的过程,工业上也叫煤的焦化 | |
| D. | 糖类、油脂、蛋白质是为了人类生命活动提供能量的基本营养物质,都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O(重水)含有的质子数、电子数和中子数均为10NA | |
| B. | 2molSO2和1molO2通入密闭容器中,发生反应2SO2(g)+O2(g)$\frac{\underline{\;催化剂\;}}{△}$2SO3(g),反应完成时,生成SO3分子数小于2NA | |
| C. | 7.8gNa2O2固体含有的离子数为0.4NA | |
| D. | 2.24LH2完全燃烧时,断裂H-H键数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②④⑥⑦ | C. | ③④⑥⑦ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com