
| A. | 体积不变,增加H2O(g)的量 | |
| B. | 保持体积不变,充入Ne使体系压强增大 | |
| C. | 将容器的体积缩小一半 | |
| D. | 压强不变,充入He使容器的体积增大 |
分析 对于反应3Fe(s)+4H2O(g)?Fe3O4+4H2(g)来说,增大压强、浓度、升高温度以及增大固体的表面积,都可增大反应速率,以此解答.
解答 解:A.增加H2O(g)的量,气体浓度增大,反应速率增大,故A不选;
B.保持体积不变,充入Ne使体系压强增大,但参加反应气体的浓度不变,则反应速率不变,故B选;
C.将容器的体积缩小一半,气体浓度增大,反应速率增大,故C不选;
D.压强不变,充入Ne使容器的体积增大,反应气体的浓度减小,反应速率减小,故D不选.
故选B.
点评 本题考查化学反应速率,为高频考点,侧重于学生的分析能力和基本理论、概念的综合理解和运用的考查,难度不大,注意相关基础知识的积累,易错点为D,注意压强与浓度的关系.


科目:高中化学 来源: 题型:解答题
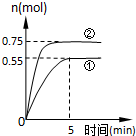 碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:
碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 负极发生的反应为:Fe-2e-=Fe 2+ | |
| C. | 正极发生的反应为:2H2O+O2+2e-=4OH- | |
| D. | 钢柱在水下的部分比在空气和水交界出更容易腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
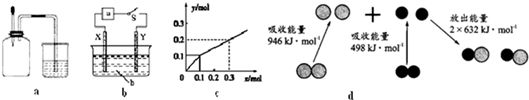
| A. | 如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 | |
| B. | 如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a | |
| C. | Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+ | |
| D. | 图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g)△H=-180 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱酸酸式盐NaHB在水溶液中水解:HB-+H2O?H3O++B2- | |
| B. | 电解盐酸:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH- | |
| D. | NaHCO3的电离:NaHCO3?Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
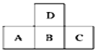
| A. | 只有A的单质存在同素异形体 | |
| B. | D的最高正价与B的最高正价相等 | |
| C. | A、B、C的最高价氧化物对应水化物的酸性强弱的关系是C>B>A | |
| D. | 原子半径的大小顺序是C>B>A>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2既是氧化产物又是还原产物 | |
| B. | 反应通式配平为6NOx+4xNH3=(3+2x)N2+6xH2O | |
| C. | 当x=1时,每生成2.5mol N2,被氧化的气体有3mol | |
| D. | 当x=2时,有1mol气体被还原时,转移的电子为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com