
分析 (1)①Fe原子核外电子数为26,原子形成阳离子先按能层高低失去电子,能层越高的电子越容易失去,同一能层中按能级高低失去电子,能级越高越容易失去;
②配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;分子晶体的熔沸点较低;
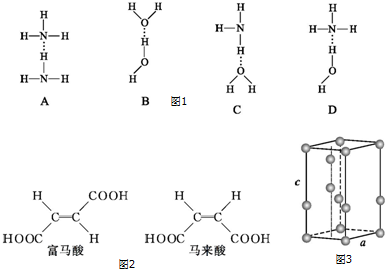
(2)NH3中只含有单键为σ键,分子中N原子含有3个σ键电子对和1个孤电子对,杂化类型为sp3;氨水中的氢键主要是氨气分子中氮原子和水分子中氢原子间的氢键;
(3)酸性氢原子参与形成氢键时,其酸性减弱;
(4)①根据晶胞中各位置,利用均摊法计算;
②根据ρ=$\frac{m}{v}$计算.
解答 解:(1)①Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5,则M层电子排布式为:3s23p63d5,
故答案为:3s23p63d5;
②配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,
故答案为:5;分子晶体;
(2)NH3中只含有单键为σ键,分子中N原子含有3个σ键电子对和1个孤电子对,杂化类型为sp3,氨水中的氢键主要是氨气分子中氮原子和水分子中氢原子间的氢键,即D选项表示的氢键,
故答案为:sp3;D;
(3)马来酸属于顺式结构,羧基上与氧原子相连的氢原子和氧原子间形成氢键,导致氢原子不易电离,酸性减弱;
故答案为:马来酸分子中酸性氢原子参与形成分子内氢键,其酸性减弱;
(4):①冰晶胞中顶点有8个分子,棱上有4个分子,体内有2个分子,晶胞中含有水分子的个数为:8×$\frac{1}{8}$+4×$\frac{1}{4}$+2=4,晶胞中含有4个水分子,
故答案为:4;
②ρ=$\frac{m}{v}$=$\frac{\frac{M×4}{{N}_{A}}}{{a}^{2}•c•sin6{0}^{°}}$=$\frac{\frac{18×4}{6.02×1{0}^{23}}}{45{2}^{2}×737×0.866×(1{0}^{-10})^{3}}$=0.917 g•cm-3
故答案为:0.917.
点评 本题考查物质结构和性质,涉及核外电子排布、价层电子对互斥理论、晶体性质等知识点,这些是学习难点,也是考查重点,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | N、O、F电负性依次增大 | |
| C. | P、S、Cl元素最高正价依次升高 | |
| D. | Na、K、Rb第一电离能逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | a的最高价氧化物对应的水化物是强碱 | |
| D. | b、c、d的气态氢化物的稳定性:b>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的电子式: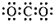 | B. | 铝离子的结构示意图: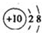 | ||
| C. | 次氯酸的结构式:H-O-Cl | D. | 质量数为18的氧原子:${\;}_{6}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H+(aq)+OH-(aq)═H20(l)△H=-57.3kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=-2×(-57.3)kJ•mol-1 | |
| B. | 由4P(s,红磷)═P4(s,白磷)△H=+139.2kJ/mol可知,红磷比白磷稳定 | |
| C. | H2(g)的燃烧热是285.8kJ•mol-1,则2H2O═2H2(g)+O2(g)△H=+571.6KJ•mol-1 | |
| D. | 恒温恒容时,将2molA和1molB投入密闭容器中,发生反应:2A(g)+B(g)?2C(g).充分反应后测得放出的热量为QkJ,则该反应的△H=-QkJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA | |
| B. | 1molC5H12分子中共价键总数为14NA | |
| C. | 78gNa2O2固体与足量的H2O反应转移的电子数为NA | |
| D. | 标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com