
| A. | 浓硫酸的作用,脱水剂、强氧化剂 | B. | “黑面包”的主要成分:C | ||
| C. | 气体的主要成分:SO2、CO2 | D. | 白色沉淀只有CaCO3 |
分析 蔗糖中含有C、H、O元素,浓硫酸具有脱水性,使蔗糖炭化,且浓硫酸和C发生氧化还原反应生成二氧化硫、二氧化碳和水,二氧化碳、二氧化硫都能使澄清石灰水变浑浊,据此分析解答.
解答 解:A.浓硫酸将蔗糖中的H、O以2:1水的形式脱去而体现脱水性,C和浓硫酸反应生成二氧化硫、二氧化碳和水,浓硫酸体现强氧化性,故A正确;
B.浓硫酸将蔗糖中的H、O以2:1水的形式脱去而生成C,所以黑面包主要成分是C,故B正确;
C.根据A知,气体的主要成分是二氧化硫、二氧化碳,故C正确;
D.二氧化碳、二氧化硫都能和氢氧化钙反应生成沉淀,所以沉淀成分是CaCO3、CaSO3,故D错误;
故选D.
点评 本题考查浓硫酸的性质,浓硫酸具有吸水性、脱水性和强氧化性,明确该反应中浓硫酸的性质是解本题关键,注意不能利用澄清石灰水鉴别二氧化碳和二氧化硫,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 能与碳酸钠反应产生气体 | B. | 能被酸性高锰酸钾氧化 | ||
| C. | 能发生酯化反应 | D. | 能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小. ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应停止了 | B. | 正反应速率与逆反应速率相等 | ||
| C. | 反应物和生成物浓度相等 | D. | 正反应速率与逆反应速率均为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO是一种红棕色气体,易溶于水 | |
| B. | 汽车尾气中NO的来源是空气中的N2与O2在汽车气缸内的高温环境下的反应产物 | |
| C. | 工业生产硝酸的原料主要有NO和空气 | |
| D. | 由于NO在血管中的特殊作用,所以NO无毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入品红溶液或者溴水都能使它们褪色,均说明SO2具有漂白性 | |
| B. | 蘸有浓氨水和蘸有浓HNO3的玻璃棒靠近时有白烟产生,是因为氨气有还原性 | |
| C. | 某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,说明溶液中一定没有NH4+ | |
| D. | NH3•H2O的热不稳定性可以解释实验室中用加热氨水的办法制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA溶液的导电性较弱,则HA为弱酸 | |
| B. | S02的水溶液能导电,则S02为电解质 | |
| C. | HC1在水中能完全电离,则盐酸为强电解质 | |
| D. | BaS04是电解质,但其水溶液不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在NaCl晶体中,距Na+最近的Cl-有6个 | |
| B. | 在NaCl晶体中,每个晶胞实际拥有4个Na+、4个Cl- | |
| C. | 在金刚石晶体中,碳原子与碳碳键的数目比为1:4 | |
| D. | 在金刚石晶体中,最小环是由6个碳原子构成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
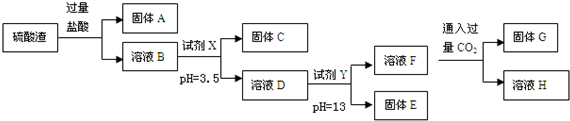
| 阳离子 | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
| 沉淀完全时的pH | 3.2 | 5.2 | 11.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com