
| A. | 某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键 | |
| B. | 在水溶液中能导电的化合物一定是离子化合物 | |
| C. | 共价化合物溶于水,分子内共价键被破坏,单质溶于水,分子内共价键不被破坏 | |
| D. | 含有离子键的物质不可能是单质 |
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:解答题
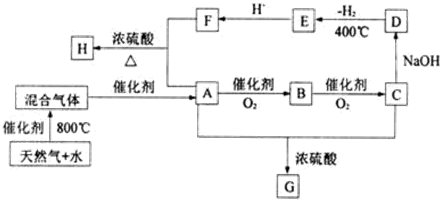
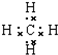 ;E的化学式是Na2C2O4.
;E的化学式是Na2C2O4.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
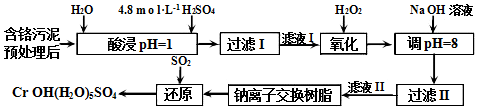
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
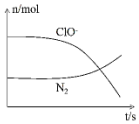 某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )| A. | 该反应中Cl-为氧化产物 | B. | 消耗1 mol还原剂,转移6 mol电子 | ||
| C. | 反应后溶液的酸性减弱 | D. | NH4+被ClO-氧化成N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
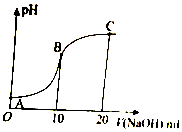 已知:苯酚(
已知:苯酚(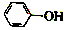 )在水中的电离方程式为
)在水中的电离方程式为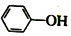 ?
?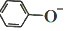 +H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )
+H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )| A. | A点溶液中,苯酚的电离度约为0.01% | |
| B. | B点溶液的pH<7 | |
| C. | C点溶液中存在c(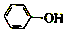 )>c(OH-)>c(H+) )>c(OH-)>c(H+) | |
| D. | A 点溶液加少量水稀释,溶液中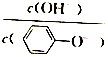 减小 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 除去NH4Cl溶液中的Fe3+ | 加入氨水至不再产生沉淀为止,然后过滤 |
| B | 检验某溶液中是否存在SO32- | 取少量溶液于试管中,滴加盐酸酸化的硝酸钡 |
| C | 证明Mg的金属性强于Al | 分別向MgCl2、AlCl3的溶液中加人足量的氨水 |
| D | 配制 100 mL0.lmol•L-1H2SO4溶液 | 用量筒量取 20 mL 0.5 mol•L-1 H2SO4 溶液沿玻璃棒注入含有80mL水的烧杯中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| B. | 向醋酸溶液中加水,醋酸的电离程度增大,$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$增大 | |
| C. | 向氨水中滴加盐酸时,离子浓度大小可能是:c(NH4+)>c(OH-)>c(Cl-)>c(H+) | |
| D. | 若NaHA溶液中的pH>7,则H2A是弱酸;若NaHA溶液中的pH<7,则H2A是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com