
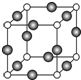
 已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子价电子构型为:nsnnpn;钠在W的单质中燃烧生成淡黄色固体;K位于ds区且原子的最外层电子数与X的相同.请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子价电子构型为:nsnnpn;钠在W的单质中燃烧生成淡黄色固体;K位于ds区且原子的最外层电子数与X的相同.请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)| 1 |
| 4 |
| 1 |
| 8 |


科目:高中化学 来源: 题型:
| A、78g Na2O2晶体中所含阴、阳离子的物质的量均为2 mol |
| B、1个乙烯分子中存在6对共用电子对 |
| C、NaOH和Na2O中所含的化学键类型完全相同 |
| D、PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降低体系的温度 |
| B、增大容器的体积 |
| C、体积不变充入N2 |
| D、将NH3及时移走 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0mol/L的酸性KMnO4溶液中:CH3CH2OH、SO42-、Cu2+、Na+ |
| B、通入SO2后的溶液中:CO32-、Br-、K+、NH4+ |
| C、中性溶液:Fe3+、Al3+、Cl-、NO3- |
| D、pH=2的溶液中:Cu2+、CH3CHO、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| B、温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw不变 |
| C、8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 |
| D、由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol?L-1 | 0.100 | c1 | 0.050 | c3 | c3 |
| c(NO2)/mol?L-1 | 0.00 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com