
【题目】不能用于区别二氧化氮和溴蒸气的试剂是( )
A.AgNO3溶液B.蒸馏水
C.CCl4D.淀粉KI溶液
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】石油裂解气用途广泛,可用于合成各种橡胶和医药中间体。利用石油裂解气合成CR橡胶和医药中间体K的线路如下:
已知: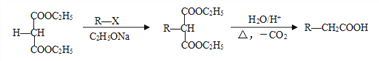
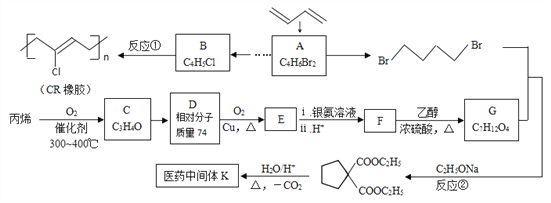
(1)A的反式异构体的结构简式为____________________ 。
(2)用系统命名法给B命名,其名称是__________________。
(3)依次写出①、②的反应类型、____________ 、____________。
(4)C、D、E均为链状结构,且均能与新制氢氧化铜悬浊液共热生成砖红色沉淀,则C中含有的官能团名称是________________________。 写出反应D→E的化学方程式_______________________________________________________。
(5)K的结构简式为_____________________________。
(6)写出F与乙二醇发生聚合反应的化学方程式___________________________________。
(7)写出同时满足下列条件的医药中间体K的所有同分异构体的结构简式_____________。
a.与E互为同系物 b.核磁共振氢谱有3种峰
(8)已知双键上的氢原子很难发生取代反应。以A为起始原料,选用必要的无机试剂合成B,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A.在稀硫酸中加入铜粉,铜粉不溶解,再加入 Cu(NO3)2 固体,铜粉可以溶解
B.某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性
C.浓硝酸性质稳定,见光也不易分解
D.HNO3→NO→NO2,以上各步变化均能通过一步实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、E、F、G七种元素为周期表中原子序数依次增大的前四周期元素。6X的一种核素能用于测定文物的年代;Y元素最高价氧化物对应水化物能与其常见氢化物反应生成盐M;Z原子核外成对电子数是未成对电子数的3倍;W的原子半径在同周期主族元素中最大;E的基态原子的所有电子位于四个能级且每个能级均全充满;F的电负性在同周期中最大;G的基态原子N层只有一个电子,内层电子全部排满。请回等下列问题: (用X、Y、Z、W、E、F、G所对应的元素符号表示)
(1)写山F的基态原子的核外电子排布式:______________。
(2)Y、Z、W的电负性由大到小的顺序为_____________。
(3)以下可以表示X的基态原子的原子轨道表示式的是____________。
A. ![]() B.
B. ![]() C.
C. ![]()
(4)下图可以表示F的氢化物中电子云重叠方式的是_______。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(5)基态E原子核外存在_____种运动状态不同的电子。
(6)G元素位于周期表中的_____区,基态原子价电子排布式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧族元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)下面曲线表示卤族元素某种性质随核电荷数的变化趋势。正确的是_______。

(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为_______。
(3)F2与其他卤素单质反应可以生成CF3、BrF3等。已知反应Cl2(g)+3F2(g)=2C1F3(g)△H=-313kJ/mo1;F-F键的键能为159 kJ/mo1;,Cl-C1键的键能为242 kJ/mo1;则ClF3中C1-F键的平均健能为____kJ/mol。ClF3的熔、沸点比BrF3的______(填“高”或“低”)。
(4)根据第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(5)无机含氧酸HmROn可以写成(HO)mROn-m的形式,(n-m)的值越大,HmROn的酸性越强。则酸性:H2SeO4_____H2SeO3(填“<”或“>”)。
(6)S的常见单质S8的结构为![]() ,S原子的轨道杂化方式是______。
,S原子的轨道杂化方式是______。
(7)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体。CH4与H2O形成的水合物俗称“可燃冰”。“可燃冰“中存在的分子间作用力是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)汽车尾气中的处理NO的方法也可用H2将NO还原为N2。
已知: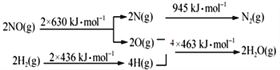
H2还原NO生成氮气和水蒸气的热化学方程是_______________________________。
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理为CO(g)+2H2(g)![]() CH3OH(g) ΔH。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH 的体积分数在不同压强下随温度的变化如图。
CH3OH(g) ΔH。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH 的体积分数在不同压强下随温度的变化如图。
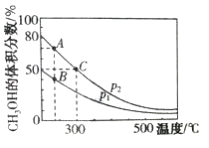
①上述合成甲醇的反应是__________________(填“吸热”或“放热”)反应,图像中的压强p1、p2的大小关系是_______________,判断的理由是________________________。
②从上图A、B、C三点中选填下表物理量对应最大的点(用“A”、“B”或“C”填写)。
反应速率V | 平衡常数K | 平衡转化率a |
____________ | _____________ | _____________ |
③在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25molCH3OH。该平衡_________(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(3)有利于提高CO平衡转化率的措施有_________________。
A.使用催化剂 B.投料比不变,增加CO的浓度
C.降低反应温度 D.通入He气体使体系的压强增大
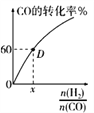
(4)一定温度下,CO的转化率与起始投料比![]() 的变化关系如图所示,测得D点氢气的转化率为40%,则x=__________________。
的变化关系如图所示,测得D点氢气的转化率为40%,则x=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础。
实验室欲分离乙酸(沸点为118℃)和乙醇(沸点为78℃)的混合物,请按要求作答。
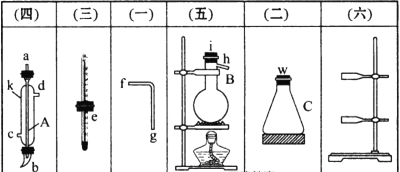
(1)图中A、B两种仪器的名称是________、________。
(2)A仪器中进水口是________(填“c”或“d”)。
(3)分离混合物时,温度计的________应处于______________。
(4)在B中注入混合物后,加入几片碎瓷片的目的是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com