
(4分)有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Al3+、Fe3+、SO42―、CO32―、Cl―和I―。你取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中最终无沉淀;
(4)取部分上述碱性溶液,通入过量CO2气体有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;根据上述实验事实,你可知道该溶液中:
① 肯定含有的离子是 ;
② 肯定不存在的离子是 ;
(4分)① NH4+、Al3+、I― ②Mg2+、Fe3+、CO32―
【解析】
试题分析:(1)用pH试纸检验,表明溶液呈强酸性则由于H+与CO32―会发生复分解反应而不能大量共存,所以一定不含有CO32―;(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色,证明含有I-,由于I-与Fe3+会发生离子反应而不能大量共存,所以不含有Fe3+;(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中最终无沉淀,证明无Mg2+;(4)取部分上述碱性溶液,通入过量CO2气体有白色沉淀生成则证明含有Al3+;(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝证明在溶液中含有NH4+,综上所述① 肯定含有的离子是NH4+、Al3+、I―;② 肯定不存在的离子是Mg2+、Fe3+、CO32― 。
考点:考查离子的鉴定和离子共存的知识。


科目:高中化学 来源:2015届山东省高三上学期第二次月考联考化学试卷(解析版) 题型:实验题
6分)制备Cl2需用8 mol?L-1的盐酸100mL,现用12 mol?L-1的盐酸来配制。
①需要12 mol?L-1的盐酸的体积为 mL(精确到0.1 mL)
②为完成配制,除玻璃棒,小烧杯外,还需要选择的仪器为 。
A 100mL量筒 B托盘天平 C 100mL容量瓶 D.50mL容量瓶
E.10mL量筒 F.胶头滴管
③ 在容量瓶的使用方法中,下列操作中,不正确的是 (填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C. 配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近刻度线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
查看答案和解析>>
科目:高中化学 来源:2015届山东省邹城市高三10月月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A. 亚硫酸钠溶液加入稀硝酸:SO32-+2H+= SO2↑+H2O
B.碘水中通入足量的SO2:I2 +SO2+2H2O=2I-+SO42-+4H+
C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源:2015届山东省菏泽市高三上学期期中联考化学试卷(A)(解析版) 题型:选择题
下列说法正确的是
A.我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B.需要通过化学反应才能从海水中获得食盐和淡水
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.工业制粗硅涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2?6H2O晶体后,仍能大量共存的是
A.Na+、H+、Cl-、NO3- B.Na+、Mg2+、Cl-、SO42-
C.K+、Ba2+、OH-、I- D.Cu2+、CO32-、Br-、ClO-
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
设NA表示阿伏伽德罗常数,下列说法中不正确的是( )
A.一定量的Fe与含1molHNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.1molFeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D.125gCuSO4?5H2O晶体中含有0.5NA个Cu2+
查看答案和解析>>
科目:高中化学 来源:2015届山东省聊城市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其原子的电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )
A. Z与Y形成的化合物可作为耐高温材料
B.WY2能与碱反应,但不能与任何酸反应
C.原子半径按X、Y、Z、R、W的顺序依次增大
D.熔沸点:X2R>X2Y
查看答案和解析>>
科目:高中化学 来源:2015届山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:填空题
(14分)铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是
A.纯铁硬度比生铁高
B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素
D.铁在一定条件下,可与水蒸气反应
E.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1mol·L-1FeC13溶液,至液体呈透明的红褐色,该反应的离子方程式为 ,形成该分散系的微粒粒度范围是 。
(3)电子工业需用30%的FeC13溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出 FeC13溶液与铜反应的离子方程式 。欲从腐蚀后的废液中回收铜并重新获得FeC13溶液,现有下列试剂:①氯气②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水,需要用到的一组试剂是
A.①②④ B.①③④⑥ C.②④⑤ D.①④⑥
(4)高铁酸钠Na2FeO4 是一种新型净水剂。
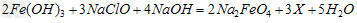 ①高铁酸钠主要通过如下反应制取:
①高铁酸钠主要通过如下反应制取:
则X的化学式为_______ ______。
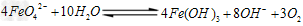 ②高铁酸钠在水中可以发生如下反应:
②高铁酸钠在水中可以发生如下反应:
由此看来,高铁酸钠能够杀菌消毒是因为它具有________性,而能够除去水中悬浮物是因为__________。
③ 下列物质能作净水剂的有 。
A.KAl(SO4)2·12H2O B.[Fe(OH)(SO4)]n C.ClO2 D.“84”消毒液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com