
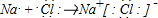 .
. .
. ②NaOH
②NaOH ③NH3
③NH3 ④N2
④N2
 ③NH3
③NH3 ④H2SH-S-H.
④H2SH-S-H. 分析 (1)氯化钠为离子化合物,钠离子与氯离子通过离子键结合而成;
(2)氯化氢为共价化合物,氢原子和氯原子通过共用电子对达到稳定结构,形成化合物;
(3)首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构;
(4)根据原子间形成的共价键数目分析,C形成4个共价键,N形成3个共价键,O形成2个共价键,H形成1个共价键.
解答 解:(1)氯化钠为离子化合物,钠离子与氯离子通过离子键结合而成,NaCl的形成过程为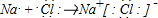 ,
,
故答案为: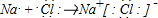 ;
;
(2)HCl属于共价化合物,氢原子最外层电子与Cl最外层电子形成一对共用电子对,其形成过程可写为 ,
,
故答案为: ;
;
(3)①MgO属于离子化合物,电子式中需要标出阴阳离子所带电荷,镁离子直接用离子符号表示,氧离子需要标出最外层电子,MgO的电子式为 ,
,
故答案为: ;
;
②氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ,故答案为:
,故答案为: ;
;
③NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,故答案为:
,故答案为: ;
;
④氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为 ,故答案为:
,故答案为: ;
;
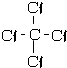
(4)C形成4个共价键,N形成3个共价键,O形成2个共价键,H形成1个共价键,则①HCN的结构式为 H-C≡N,②CCl4的结构式为  ③NH3的结构式为
③NH3的结构式为 ④H2S的结构式为 H-S-H;
④H2S的结构式为 H-S-H;
故答案为:①H-C≡N;② ;③
;③ ④H-S-H.
④H-S-H.
点评 本题考查了化学键的判断、用电子式表示物质形成过程、电子式、结构式等,明确物质的构成微粒及微粒间作用力即可判断化学键,用电子式表示物质形成构成为学习难点.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2 | B. | AlCl3 和NaOH | C. | 氩和P4 | D. | 金刚石和水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?CO32-+H3O+ | B. | H2O+H2O?H3O++OH- | ||
| C. | CO2+H2O?H2CO3 | D. | CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ③
③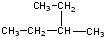 ④
④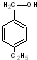 ⑤
⑤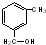 ⑥
⑥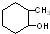
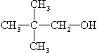 .
.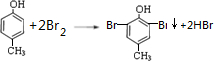 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com