
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe3+、Cl-、NO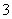 、K+
、K+
B.滴入酚酞显红色的溶液中:Na+、Mg2+、AlO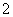 、NO
、NO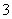
C.加入铝粉产生H2的溶液中:Fe2+、Na+、SO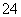 、ClO-
、ClO-
D.c(SO )=0.1 mol·L-1的溶液中:Na+、Cl-、H+、Ca2+
)=0.1 mol·L-1的溶液中:Na+、Cl-、H+、Ca2+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
1.6 g NaOH恰好与20 mL的盐酸完全反应,则盐酸的物质的量浓度为( )
A.0.2 mol·L-1 B.2 mol·L-1
C.0.5 mol·L-1 D.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素。已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个单电子,G的核电荷数比F多5。请回答下列问题(用相应的元素符号、化学式和化学术语填空)
(1)G在周期表中的位置是____,F元素的原子基态价层电子排布式__ 。
(2)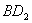 分子的电子式为__________,
分子的电子式为__________,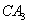 分子的空间立体构型为__________。
分子的空间立体构型为__________。
(3)A元素分别与B、D元素形成的两种微粒H、I都具有N2H4相似的结构,属于等电子数微粒,它们的化学式分别是H:__________、I:__________。
(4)向G的硫酸盐溶液中逐滴加入足量的氨水至得到的沉淀完全溶解,再向该溶液中加入一定量乙醇,析出一种深蓝色晶体。在该晶体中存在的化学键的种类有__________。
 (5)0.3g H在足量氧气中燃烧,生成气态
(5)0.3g H在足量氧气中燃烧,生成气态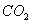 和液态
和液态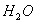 ,放出Q kJ热量,则表示H的燃烧热的热化学方程式为____________________。
,放出Q kJ热量,则表示H的燃烧热的热化学方程式为____________________。
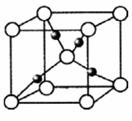
(6)G的一种氧化物的晶胞结构如图所示(黑球代表G原子),该氧化物的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是( )
A.1:3 B.2:3 C.1:1 D. 4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室制取并收集Cl2的装置。A是Cl2发生装置,,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。
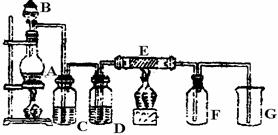
试回答:
(1)A中发生的化学反应方程式为 。
(2)C、D、G中各装的药品:C__________;D__________;G__________。
(3)E中的现象为 ;反应方程式为 。
(4)写出G中反应的离子方程式 。
(5)若将Cl2和SO2等物质的量混合漂白作用减弱,用化学方程式解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B.加热、蒸发MgCl2饱和溶液可得无水MgCl2晶体
C.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏
D.室温下,c(NH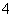 )相等的(NH4)2SO4、NH4HCO3、NH4Cl溶液中:
)相等的(NH4)2SO4、NH4HCO3、NH4Cl溶液中:
c(NH4)2SO4<c(NH4Cl)<c(NH4HCO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:
 |
⑴ 粗食盐水中含有Ca2+、Mg2+、SO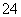 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO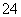 ,其原因是
,其原因是
。(已知:Ksp(BaSO4)=1.1×10-10 ;Ksp(BaCO3)=5.1×10-9)
⑵上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
⑶ ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O =2I-+S4O
=2I-+S4O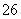 )
)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 双原子分子单质在标准状况下密度为1.429g/L |
| 单质及其化合物的焰色反应为黄色 | |
| W | W元素基态原子的M层全充满,N层只有一个电子 |
⑴ X位于元素周期表位置为第第__________周期第_________族。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。
⑵ X与Y中电负性较强的是(填元素符号) ;XY2的电子式是 ,分子中存在 的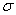 键和
键和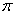 键的个数比是 。
键的个数比是 。
⑶Z2Y2中含有的化学键类型有 ;W的基态原子核外电子排布式是 。
⑷废旧印刷电路板上有W的单质A。用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A。已知:
A(s)+H2SO4 (aq) == ASO4 (aq) + H2(g) ΔH=+64.4kJ·mol-1
2H2O2(l) == 2H2O(l) + O2(g) ΔH= -196.4kJ·mol-1
H2(g)+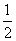 O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示):
 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com