
| A、用加热NH4Cl的方法制氨气 |
| B、将CuSO4?5H2O置于蒸发皿中加热除去结晶水 |
| C、用金属钠检验酒精中是否含有水 |
| D、用饱和FeCl3溶液和沸水反应制备Fe(OH)3胶体 |


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、除去SO42-最合适的试剂是BaCl2 |
| B、工业上通过电解氯化钠溶液制备金属钠和氯气 |
| C、室温下,AgCl在水中的溶解度大于在食盐水中的溶解度 |
| D、用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
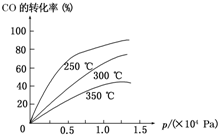 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇:| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
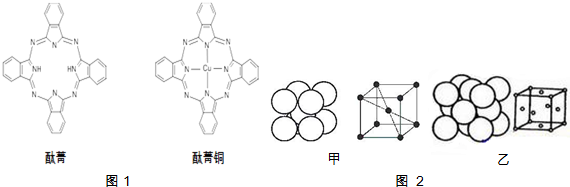
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①③④ |
| C、②③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
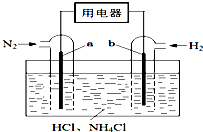 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如右图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如右图所示.下列有关分析正确的是( )| A、a为电池的负极 |
| B、通入N2一极的电极反应式为:N2+6e-+8H+═2NH4+ |
| C、电池工作一段时间后,溶液pH减小 |
| D、电流的方向是由b经用电器到a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质水解的最终产物是多肽 |
| B、淀粉水解的最终产物是葡萄糖 |
| C、纤维素不能水解成葡萄糖 |
| D、油脂水解产物之一是甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol?L-1) | 0.08 | 1.6 | 1.6 |
| A、此时刻反应达到平衡状态 |
| B、容器内压强不变时,说明反应达平衡状态 |
| C、平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变 |
| D、平衡时,反应混合物的总能量降低40kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com