
| A. | 乙烷 | B. | 甲苯 | C. | CH2=CH-CN | D. | 异戊二烯 |
分析 A.乙烷中C为四面体结构;
B.甲苯中甲基上C为四面体结构;
C.碳碳双键为平面结构、C≡N为直线结构;
D.异戊二烯为CH2=C(CH3)CH=CH2,甲烷上C为四面体结构.
解答 解:A.乙烷中C为四面体结构,乙烷中最多4个原子共面,故A错误;
B.甲苯中甲基上C为四面体结构,则甲苯中最多13个原子共面,故B错误;
C.碳碳双键为平面结构、C≡N为直线结构,且二者直接相连,所有原子都处于同一平面,故C正确;
D.异戊二烯为CH2=C(CH3)CH=CH2,甲烷上C为四面体结构,则甲基上2个H不能与双键C共面,故D错误;
故选C.
点评 本题考查有机物的结构,为高频考点,把握甲烷、烯烃的结构为解答的关键,侧重分析与应用能力的考查,注意甲烷中最多3个原子共面,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化产物和还原产物的物质的量之比为2:1 | |
| B. | 转移4 mol电子时,只需向装置中通人44.8 L H2(标准状况) | |
| C. | 装药品之前加热装置至100℃并持续一会儿 | |
| D. | 制备硼氢化钠的副产物可能有NaH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
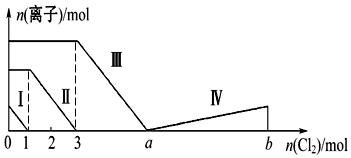
| A. | 线段Ⅱ表示Br-的变化情况 | B. | 原溶液中n(FeBr2):n(FeI2)=1:3 | ||
| C. | 线段Ⅳ表示IO3-的变化情况 | D. | 根据图象无法计算a的值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| B. | 14g乙烯和丙烯混合气体中的氢原子数为2NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{z}{12m}$ | B. | $\frac{12z}{m}$ | C. | $\frac{{N}_{A}}{m}$ | D. | $\frac{{N}_{A}}{z}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 | 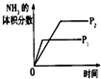 | 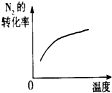 | 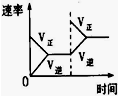 | 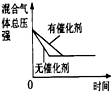 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com