
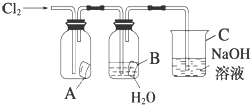
 某同学按图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液.请回答下列问题.
某同学按图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液.请回答下列问题.分析 (1)A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,则氯气不能使A中纸条褪色,而B中生成HClO,所以纸条褪色;
(2)氯气有毒,不能排放在空气中,利用NaOH溶液吸收.
解答 解:(1)A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,则氯气不能使A中纸条褪色,而B中生成HClO,所以纸条褪色,则A中没有明显现象,B中褪色,因B中生成的HClO具有漂白性,反应的离子方程式为Cl2+H2O=H++Cl-+HClO,
故答案为:无明显现象;纸条褪色;氯气无漂白作用,氯气与水反应生成的HClO具有漂白作用;Cl2+H2O=H++Cl-+HClO;
(2)氯气有毒,不能排放在空气中,利用NaOH溶液吸收,所以C的作用为除去多余的Cl2气,防止污染环境,发生的反应为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:吸收多余的氯气,防止污染环境; Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题以氯气的性质为载体考查性质实验方案的设计,注意A、B装置的对比作用及环境保护为解答的关键,把握HClO具有漂白性即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子结构中不存在手性碳 | |
| B. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | SO2、SO3都是极性分子 | |
| D. | 原子晶体中原子以共价键结合,具有键能大、硬度大的特性 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$ .
. .
. 路线流程图(无机试剂任选).合成路线流程图示例如下:
路线流程图(无机试剂任选).合成路线流程图示例如下: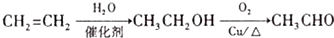
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com