
【题目】将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.
(1)加入NaOH20~200mL时发生反应离子方程式;加入NaOH200~240mL时发生反应离子方程式 .
(2)镁和铝的总质量为g.
(3)硫酸的物质的量浓度为 .
(4)生成的氢气在标准状况下的体积为L.
【答案】
(1)Mg2++2OH﹣=Mg(OH)2↓、Al3++3OH﹣=Al(OH)3↓;Al(OH)3+OH﹣=AlO ![]() +2H2O
+2H2O
(2)9
(3)2.5 mol/L
(4)10.08
【解析】解:(1)由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O,离子方程式为:OH﹣+H+=H2O;当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3 , 发生反应为:Mg2++2OH﹣=Mg(OH)2↓、Al3++3OH﹣=Al(OH)3↓;从200mL到240mL,NaOH溶解Al(OH)3 , 反应的离子方程式为:Al(OH)3+OH﹣=AlO ![]() +2H2O, 所以答案是:Mg2++2OH﹣=Mg(OH)2↓;Al3++3OH﹣=Al(OH)3↓;Al(OH)3+OH﹣=AlO
+2H2O, 所以答案是:Mg2++2OH﹣=Mg(OH)2↓;Al3++3OH﹣=Al(OH)3↓;Al(OH)3+OH﹣=AlO ![]() +2H2O;(2)根据天下可知Mg(OH)2和Al(OH)3的物质的量之和为0.35mol,从200mL到240mL,NaOH溶解Al(OH)3 , 当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2 , 物质的量为0.15mol,所以沉淀量最大,Mg(OH)2为0.15mol,Al(OH)3为0.35mol﹣0.15mol=0.2mol,
+2H2O;(2)根据天下可知Mg(OH)2和Al(OH)3的物质的量之和为0.35mol,从200mL到240mL,NaOH溶解Al(OH)3 , 当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2 , 物质的量为0.15mol,所以沉淀量最大,Mg(OH)2为0.15mol,Al(OH)3为0.35mol﹣0.15mol=0.2mol,
由元素守恒可知n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol,
所以镁和铝的总质量为0.2mol×27g/mol+0.15mol×24g/mol=9g,
所以答案是:9;(3)沉淀量最大时为Mg(OH)2和Al(OH)3 , 溶液中溶质为Na2SO4 , 根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的0.5倍,所以n(Na2SO4)=0.5×0.2L×5mol/L=0.5mol,所以硫酸的浓度为 ![]() =2.5mol/L,
=2.5mol/L,
所以答案是:2.5;(4)根据以上分析,由元素守恒可知金属镁和铝物质的量分别为0.15mol和0.2mol,根据得失电子守恒氢气在标准状况下的体积为: ![]() ×22.4L=10.08L,
×22.4L=10.08L,
故答案:10.08.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A.pH=1的NaHSO4溶液:c(H+)=c(SO ![]() )+c(OH﹣)
)+c(OH﹣)
B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl﹣)=c(I﹣)
C.CO2的水溶液:c(H+)>c(HCO ![]() )=2c(CO
)=2c(CO ![]() )
)
D.含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O ![]() )+c(C2O
)+c(C2O ![]() )+c(H2C2O4)]
)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:

回答下列问题:
(1)基态钛原子的价电子排布图为___________________,其原子核外共有_____种运动状态不相同的电子。金属钛晶胞如下图2所示,为________________堆积(填堆积方式)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l-l >> l-b > b-b(l为孤对电子对,b为键合电子对),则关于H2O中的H-O-H键角可得出的结论是________。
A.180° B.接近120°,但小于120°
C.接近120°,但大于120° D.接近109°28’,但小于109°28’
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃,可知TiCl4为______晶体。
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图1。化合物乙的沸点明显高于化合物甲,主要原因是___________________________。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为__________________。

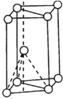
图1 图2
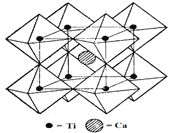
(5)钙钛矿晶体的结构如右图所示。钛离子位于立方晶胞的角顶,被_______个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被__________个氧离子包围。钙钛矿晶体的化学式为_______。若该晶胞的边长为a pm,则钙钛矿晶体的密度为______________g.cm-3(只要求列算式,不必计算出数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________________________。
(2)烧杯间填满碎纸条的作用是________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏大、偏小、无影响”)
(4)如果用50mL0.50mol/L硝酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________________(填“相等、不相等”),所求中和热__________(填“相等、不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是( )
A. 氯化铁溶液止血
B. 河流入海处易形成沙洲
C. 在豆浆里加入盐卤做豆腐
D. 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3 , 含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题.
(1)流程甲加入盐酸后生成Al3+的离子方程式为 .
(2)流程乙加入烧碱后生成SiO ![]() 的离子方程式为 .
的离子方程式为 .
(3)验证滤液B含Fe3+ , 可取少量滤液并加入(填试剂名称)
(4)滤液E、K中溶质的主要成分是(填化学式),写出该溶质的一种用途. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法正确的是
A.葵花籽油、人造奶油、牛油均属于高级脂肪酸高级酯
B.无法通过质谱图分析区分乙醇和乙酸乙酯
C.因为人体中没有水解纤维素的酶,所以食用富含纤维素的食品没有意义
D.石油裂解、煤的干馏、玉米制醇、纤维素制火棉都是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向下列溶液中加入少量的过氧化钠固体,不会出现浑浊的是 ( )
A.Na2CO3溶液
B.FeCl3溶液
C.饱和Ca(OH)2溶液
D.CuSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com