
| A.95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.pH=3的醋酸溶液,稀释10倍后pH=4 |
| C.0.2mol/L的盐酸与等体积水混合后pH=1 |
| D.常温下,pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
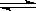 CH3COO-+ H+)正向移动,所以稀释10倍后,10-4<C(H+)<10-3,则4<PH<3,故B错误;
CH3COO-+ H+)正向移动,所以稀释10倍后,10-4<C(H+)<10-3,则4<PH<3,故B错误;

科目:高中化学 来源:不详 题型:单选题
| A.人类目前所直接利用的能量大部分是由化学反应产生的 |
| B.煤、石油、天然气是当今世界最重要的三种化石燃料 |
| C.我国目前最重要的能源是煤炭 |
| D.人体运动所消耗的能量与化学反应无关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将pH=4的醋酸溶液稀释后,H+浓度增大 |
| B.常温下,0.01LpH=10的NaOH溶液加水稀释到10L,此时溶液的PH=7 |
| C.改变条件使醋酸的电离平衡向右移动,醋酸的电离度一定增大 |
| D.常温下0.1mol·L-1醋酸溶液的pH=a,加入适量的醋酸钠固体能使溶液pH=(a+1) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 5.70 | 25.70 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.[Na+]=2[CO32- ] | B.[OH一]=2[H+] |
| C.[HCO3- ]>[H2CO3] | D.[Na+]<([CO32-]+[HCO3- ]) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.吸热反应的反应物总能量低于生成物总能量 |
| B.绿色植物进行光合作用时,将光能转化为化学能“贮存”起来 |
| C.物质的化学能可以在不同条件下转为热能、电能、光能等为人类所利用 |
| D.天然气属于二次能源 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.根据一次能源和二次能源的划分,氢气是二次能源 |
| B.电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源 |
| C.火电是将燃料中的化学能直接转化为电能的过程 |
| D.在火电过程中,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.9 | B.10 | C.11 | D.12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B.c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) | D.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com