
某元素M的单质1.8g在过量的O2中充分燃烧,得到M2O33.4g,已知M原子核外电子数比核内中子数少1。该元素在周期表中的位置是( )
A、第2周期ⅢA族 B、第2周期ⅥA族 C、第3周期ⅤA族 D、第3周期ⅢA族
科目:高中化学 来源: 题型:阅读理解

 化合
化合查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:陕西省宝鸡中学2011-2012学年高二下学期期末考试化学试题 题型:013
|
某元素M的单质1.8 g在过量的O2中充分燃烧,得到M2O3 3.4 g,已知M原子核外电子数比核内中子数少1.该元素在周期表中的位置是 | |
| [ ] | |
A. |
第2周期ⅢA族 |
B. |
第2周期ⅥA族 |
C. |
第3周期ⅤA族 |
D. |
第3周期ⅢA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(11分)图表法、图象法是常用的科学研究方法。阅读下列图表回答问题:
(1)第三周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的_____族,根据同周期元素第一电离能的变化规律,推断在M元素所在周期的所有元素中,M元素的第一电离能的大小(最小)范围为______<M<________(填元素符号)。
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第_______族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是:______(填“a”或“b”),请说明A点代表的的氢化物的沸点较高的原因_____________________________________________。
(3) 图C是表示表示第三周期8种元素单质的熔点(℃)折线图,已知序号“1”对应的点代表Ar,其中序号“8”代表 _______(填元素符号);其中电负性最大的是_________(填图C中的序号)。
查看答案和解析>>
科目:高中化学 来源:2010年厦门双十中学高三考前热身卷理科综合(化学) 题型:填空题
[化学——物质结构与性质](13分)
(1)金属钛(22Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,写出Ti元素的基态原子电子排布式为 ;
(2)日常生活中广泛应用的不锈钢,在其生产过程中添加了铬元素,该元素基态原子未成对电子数为 。
(3)COCl2俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间的共价键含有 (填字母): a.2个σ键;b.2个π键;c.1个σ键、1个π键。
(4)①短周期某主族元素M的逐级电离能情况如下图A所示,则M元素位于周期表的第
族。
②第三周期8种元素按单质熔点高低的顺序如下图B所示,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图B中的序号)。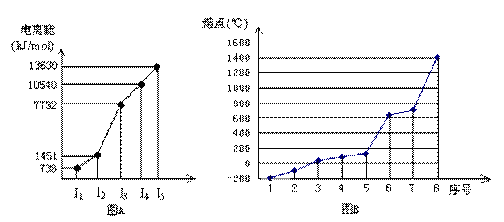
(5)由C原子跟Si原子以1 : 1相互交替结合而形成的晶体,晶型与晶体Si相同。两者相比熔点更高的是 (填化学式)试从结构角度加以解释: 。
(6)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com