
| A、把浑浊的液体倒入蒸发皿内加热 | ||
| B、开始析出晶体后用玻璃棒搅拌 | ||
C、蒸发时液体不超过蒸发皿容积的
| ||
| D、蒸发皿中出现大量固体时即停止加热 |
| 2 |
| 3 |
| 2 |
| 3 |


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
 某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)△H<0反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)△H<0反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数是99 |
| B、电子数是43 |
| C、中子数是99 |
| D、质量数是43 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol、0.2mol、0.1mol |
| B、0.2mol、0.3mol、0.2mol |
| C、0.1mol、0.5mol、0.2mol |
| D、0.1mol、0.3mol、0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应放出的热量为0.04a KJ |
| B、平衡时H2O的转化率为40% |
| C、若将容器的体积压缩为1L,有利于该反应平衡正向移动 |
| D、判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
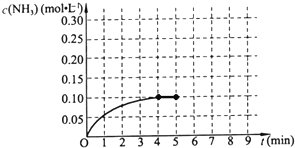 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com