
【题目】某同学用质量分数为36.5%,密度为116g/cm3的浓盐酸配制240mL 1mol/L的稀盐酸。请回答下列问题:
(1)需要量取浓盐酸______mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯外,还必须用到的仪器有______。
(3)在配制过程中,若用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度将______(填“偏高”、“偏低”、“无影响”,下同)。若量取的浓盐酸经稀释、冷却至室温,注入用蒸馏水洗涤后未干燥的容量瓶中,则配制的稀盐酸浓度将_______。若定容时俯视观察凹液面最低点与刻线相平,则配制的稀盐酸浓度将为_______。若用该方法配制氢氧化钠溶液,则操作过程中动作要快,否则会造成浓度___;试分析造成此变化的原因是_______。
(4)若在标准状况下,将VLHCl气体溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,则所得盐酸溶液的物质的量浓度为_______mol/L。
【答案】 21.6 250mL容量瓶、胶头滴管、玻璃棒(可颠倒) 偏低 无影响 偏高 偏低 NaOH易潮解、易吸收空气中的CO2而变质 ![]()
【解析】(1)浓盐酸的物质的量浓度c(HCl)=![]() =
=![]() mol·L-1=11.6mol·L-1,设所需浓硫酸的体积为V,则有V×11.6mol·L-1=0.25L×1mol·L-1,则
mol·L-1=11.6mol·L-1,设所需浓硫酸的体积为V,则有V×11.6mol·L-1=0.25L×1mol·L-1,则
V=![]() =0.0216L=21.6mL;(2)根据操作步骤:计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用30mL量筒量取(用到胶头滴管)浓盐酸,在烧杯中稀释,用玻璃棒搅拌,冷却至室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.所以还需要的仪器为:玻璃棒、胶头滴管、250mL容量瓶。(3)在配制过程中,若用刚刚洗涤洁净的量筒来量取浓盐酸,量筒壁上的水导致浓盐酸浓度减少,所量取溶液中溶质的质量减少,其配制的稀盐酸浓度将偏低。若量取的浓盐酸经稀释、冷却至室温,注入用蒸馏水洗涤后未干燥的容量瓶中,对溶质的物质的量和最终溶液的体积没有影响,浓度不变。若定容时俯视观察凹液面最低点与刻线相平,溶液体积偏大,则配制的稀盐酸浓度将偏低。若用该方法配制氢氧化钠溶液,则操作过程中动作要快,否则会造成浓度偏低;试分析造成此变化的原因是NaOH易潮解、易吸收空气中的CO2而变质。(4)根据V=
=0.0216L=21.6mL;(2)根据操作步骤:计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用30mL量筒量取(用到胶头滴管)浓盐酸,在烧杯中稀释,用玻璃棒搅拌,冷却至室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.所以还需要的仪器为:玻璃棒、胶头滴管、250mL容量瓶。(3)在配制过程中,若用刚刚洗涤洁净的量筒来量取浓盐酸,量筒壁上的水导致浓盐酸浓度减少,所量取溶液中溶质的质量减少,其配制的稀盐酸浓度将偏低。若量取的浓盐酸经稀释、冷却至室温,注入用蒸馏水洗涤后未干燥的容量瓶中,对溶质的物质的量和最终溶液的体积没有影响,浓度不变。若定容时俯视观察凹液面最低点与刻线相平,溶液体积偏大,则配制的稀盐酸浓度将偏低。若用该方法配制氢氧化钠溶液,则操作过程中动作要快,否则会造成浓度偏低;试分析造成此变化的原因是NaOH易潮解、易吸收空气中的CO2而变质。(4)根据V=![]() =
= ,则c=
,则c=![]() =
= =
= mol·L-1。
mol·L-1。


科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是( )
A. 18个纵行代表18个族,7个主族、8个副族
B. 短周期共有32种元素
C. 元素周期表共有7个横行代表7个周期
D. 第ⅠA族全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用离子方程式H++OH-→H2O表示的反应是( )
A. 稀硫酸和氢氧化钾 B. 稀硫酸和氢氧化钡溶液
C. 氢硫酸和氢氧化钠溶液 D. 稀硝酸和氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目信息完成下列方程式。
(1)已知硫酸铅(PbSO4)不溶于盐酸也不溶于硝酸,但可溶于醋酸铵(CH3COONH4)溶液中形成无色溶液,其化学方程式为PbSO4 + 2CH3COONH4 = (CH3COO)2Pb + (NH4)2SO4。当在(CH3COO)2Pb溶液中通入H2S气体时,有黑色PbS沉淀生成,则此反应的离子方程式为__________________.
(2)钛(Ti)因为具有神奇的性能越来越引起人们的关注。地壳中含钛铁矿石之一是金红石(TiO2),目前大规模生产的方法是:
第一步:金红石、炭粉混合,在高温条件下,通入Cl2制得TiCl4和一种可燃气体,该反应的化学方程式为:____________________________________________;
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。写出此反应的化学方程式:____________________________________________。
(3)用100mL 0.1mol/L的NaOH溶液吸收224mLCO2气体(标准状况),恰好完全吸收。再将所得溶液加入100mL 0.1mol/L氢氧化钙溶液中。请写出所得溶液与氢氧化钙溶液反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M 转化为N 分两步完成:①M(g)+Q(s) ![]() R(s) ΔH1>0; ②M(g)+R(s)
R(s) ΔH1>0; ②M(g)+R(s) ![]() N(g)+Q(s) ΔH2<0。
N(g)+Q(s) ΔH2<0。
转化过程中的能量变化如图所示,下列说法正确的是

A. 反应②的逆反应的活化能为 E4 kJ·mol-1
B. 反应①的正反应的活化能一定大于 ΔH1
C. R 是该反应的催化剂
D. 2M(g) ![]() N(g)的 ΔH=(E5-E1) kJ·mol-1
N(g)的 ΔH=(E5-E1) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 金属钠投入水中:Na+H2O=Na++OH-+H2↑
B. 往酸性碘化钾溶液中滴加适量的双氧水:2I-+2H++H2O2=I2+2H2O
C. 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 氯气通入水中:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属能导电的原因是( )
A.金属晶体中金属阳离子与自由电子间的相互作用较弱
B.金属晶体中的自由电子在外加电场作用下发生定向移动
C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D.金属晶体在外加电场作用下可失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的污水中可能含有NH4+、Fe2+、Cl-、Fe3+、SO42-、HCO3-离子中的一种或几种(不考虑水中的H+、OH-),且各离子的物质的量浓度相等,为检验上述离子,某兴趣小组设计了如下实验方案:
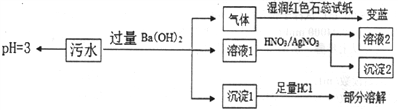
下列说法正确的是
A. 该污水pH=3是由于Fe3+水解引起的 B. 沉淀I为BaCO3和BaSO4
C. 该污水中一定存在Cl-、Fe2+离子 D. 沉淀2可能为AgCl和Ag2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
实验室以有机物 A、E 为原料,制备聚酯纤维 M 和药物中间体 N 的一种合成路线如下:
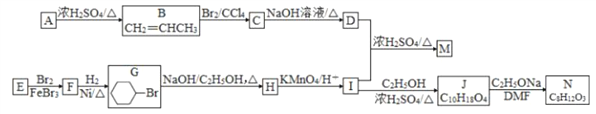
已知: ①A 的核磁共振氢谱有 3 组峰
②
③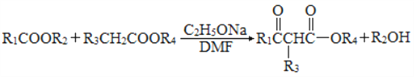 ( R1、R2、R3、R4 表示烃基)
( R1、R2、R3、R4 表示烃基)
请回答下列问题:
(1) A 的化学名称为_________。
(2) J 的结构简式为_________。
(3) B→C、G→H 的反应类型分别为_________、_________。
(4) D+I→M 的化学方程式为_________。
(5) 同时满足下列条件的 N 的同分异构体有_________种( 不考虑立体异构), 其中任意一种的结构简式为_________。
①饱和五元碳环上连有两个取代基
②能与 NaHCO3溶液反应
③能发生银镜反应
(6) 参照上述合成路线和信息, 以环庚醇和甲醇为有机原料( 无机试剂任选), 设计制备![]() 的合成路线_____________________。
的合成路线_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com