
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.常温下,16gCH4含有10NA个电子
B.标准状况下,22.4L苯含有NA个苯分子
C.标准状况下,6.72LNO2与水充分反应转移的电子数目为0.1NA
D.0.1mol.L-1CH3COOH溶液中含有0.1NA个CH3COO-
科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:选择题
常温下在下列给定的溶液中,能大量共存的粒子组是
A.能使pH试纸呈红色的溶液: CH3COOH、NH4+、I-、NO3-
B.加入铝粉生成H2的溶液:K+、Mg2+、 SO42-、HCO3-
C. c(Fe2+)=0.1mol/L的溶液:H+、Al3+、Cl-、SCN-
D.pH=14的溶液:Na+、NH3·H2O、NO3-、SiO32-
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古巴彦淖尔市高三10月月考化学试卷(解析版) 题型:选择题
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是:①过量的锌与18 mol·L-1的硫酸反应;②过量的氢气与少量氮气在催化剂存在下充分反应;③浓盐酸与过量的MnO2反应;④过量铜与浓硫酸反应;⑤过量稀硝酸与银反应;⑥过量稀硫酸与块状石灰石反应
A.②③⑤ B.②③④⑥
C.①④⑤ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古高二下学期期末考试化学试卷(解析版) 题型:填空题
(普通班)(13分)(1)常温下, CH3COONa溶液呈 性,用离子方程式解释其原因 。
(2)室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示。
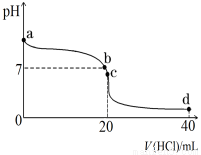
①NH3·H2O的电离方程式是 。
②b点所示溶液中的溶质是 。
③c点所示溶液中,离子浓度从大到小的关系为 ,在该溶液中存在多种守恒关系,其中c(NH4+)+c(H+)= (用离子浓度表示)。
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古高二下学期期末考试化学试卷(解析版) 题型:选择题
下列各环境下的离子组合一定能大量共存的是
A.c(HCO3-)=1×10-1mol/L的溶液中Na+、Al3+、CH3COO-、K+
B.由水电离出的c(H+)=1×10-14mol/L的溶液中CO32-、NH4+、SO42-、K+
C.甲基橙呈红色的溶液中Fe2+、Cl-、NO3-、Na+
D.能使pH试纸呈红色的溶液中Mg2+、Cl-、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014~2015江苏省高一上学期期中化学试卷(解析版) 题型:填空题
用18.4mol/L的浓H2SO4配制100mL 0.50mol/L的稀H2SO4,请按要求填空( 每 空 1分,共 计 10分)
(1)用量筒量取所需浓H2SO4的体积为 mL;
(2)如果实验室有10mL、20mL、50mL量筒,应选用 mL量筒,实验中还需要用到的仪器有 、 、烧杯、玻璃棒。
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容
②定容时俯视刻度线
③容量瓶洗净后未干燥 ;
④摇匀后发现液面低于刻度线后加水至溶液的凹液面与刻度线相平 ;
⑤用量筒量取浓H2SO4时仰视刻度线: 。
(4)若定容时液面高于刻度线应采取的措施是 。
查看答案和解析>>
科目:高中化学 来源:2014~2015江苏省高一上学期期中化学试卷(解析版) 题型:选择题
已知aAm-与bBn+具有相同的核外电子排布,则下列关系正确的是
A.a=b+m+n B.a=b-m+n C.a=b+m-n D.a=b-m-n
查看答案和解析>>
科目:高中化学 来源:2014~2015江苏省高一上学期期中化学试卷(解析版) 题型:选择题
欲配制浓度为1.00mol/L的氯化钠溶液100mL,用不到的仪器是
A.容量瓶 B.分液漏斗 C.玻璃棒 D.烧杯
查看答案和解析>>
科目:高中化学 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:填空题
(12分)Ⅰ.已知可逆反应:M(g)+N(g)  P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1。达到平衡后,M的转化率为60%,此时N的转化率为____________。
(2)若反应温度升高,M的转化率__________(填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;
达到平衡后,c(P)=2 mol·L-1,a=____________。
Ⅱ.在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应
A(g) B(g)+C(g) △H=+85.1kJ·mol-1
B(g)+C(g) △H=+85.1kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为_ ,列式并计算反应的平衡常数K 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com