
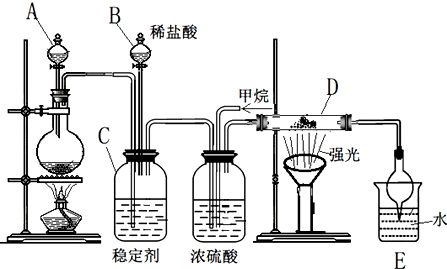
分析 (1)为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢;
(2)亚氯酸盐具有氧化性,Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子;
(3)甲烷和氯气发生取代反应生成一氯甲烷和氯化氢;
(4)反应过程中生成氯化氢,装置E是吸收氯化氢,防止倒吸的作用;
(5)甲烷和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离,氯气与甲烷反应生成产物中氯化氢、一氯甲烷为气体,其余为液态;
解答 解:(1)为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢,故滴加稀盐酸的速度要慢,
故答案为:慢;
(2)若要除去超标的亚氯酸盐,ac均不能还原亚氯酸盐,b中KI具有还原性但氧化产物不适合饮用水使用,只有d中Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子,且铁离子水解生成胶体可净化饮用水,则最适宜的是d,故答案为:d;
(3)甲烷和氯气发生取代反应生成一氯甲烷和氯化氢,反应的化学方程式为:CH4+Cl2 $\stackrel{光照}{→}$ CH3Cl+HCl,
故答案为:CH4+Cl2 $\stackrel{光照}{→}$ CH3Cl+HCl;
(4)反应过程中生成氯化氢,装置E是吸收氯化氢,防止倒吸的作用,所以选择cd,
故答案为:cd;
(5)甲烷和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;其中一氯甲烷为气态,二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开,甲烷与氯气发生取代反应生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,只有一氯甲烷是气体,还可能有过量的甲烷,故选ab.
故答案为:分液,ab;
点评 本题考查甲烷和氯气的取代反应、氯气的实验室制法,明确甲烷发生取代反应的原理及得到氯代烷的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 先生成白色沉淀,加入足量氨水后沉淀消失 | |
| B. | 生成的沉淀为AgCl,它不溶于水,但溶于氨水,重新电离成Ag+和Cl- | |
| C. | 生成的沉淀是AgCl,加入氨水后生成了可溶性的配合物[Ag(NH3)2]Cl | |
| D. | 若向AgNO3溶液中直接滴加氨水,产生的现象也是先出现白色沉淀后沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热剂焊接钢轨主要利用的是光能 | |
| B. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| C. | 1g氢气燃烧生成液态水,放出的热量为142.9 kJ,故氢气燃烧热的热化学方程式可以表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ/mol | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.
已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在晶体硅中,Si原子与Si-Si键数目比为1:2 | |
| B. | 分子晶体中都存在范德华力,分子内都存在共价键 | |
| C. | HF、HCl、HBr、HI四种物质的沸点依次升高 | |
| D. | 干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na3[AlF6] | B. | Na2[SiF6] | C. | [Cu(NH3)4](OH)2 | D. | [Pt(NH3)2Cl4]Cl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷 | B. | 甲醛 | C. | CO | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,a或b可以与水发生反应 | |
| B. | a与b用导线连接插入H2SO4中,则形成原电池且b极上有H2放出 | |
| C. | a与b用导线连接插入b(NO3)2中一定构成原电池 | |
| D. | 用惰性电极电解a(NO3)2与b(NO3)2的混合液,在阳极先析出b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com