
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2型分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L; W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径: W>Z>Y>X>M B.XZ2、X2M2、W2Z2均为直线形的共价化合物
C.由X元素形成的单质不一定是导体
D.由 X、Y、Z、M四种元素形成的化合物一定既含有离子键,又含有共价键
【知识点】元素周期律、分子结构E2 N3
【答案解析】C 解析:X、Y、Z三种元素是原子序数依次递增的同周期元素,最外层电子数之和为15,最外层电子数平均为5,X与Z可形成XZ2气态分子,X为+4价,Z为-2价,可推出X、Y、Z分别为C、N、O三种元素;
根据Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,就可计算出该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,从而确定M为H元素;
根据W的质子数是X、Y、Z、M四种元素质子数之和的1/2,W的质子数为1/2(6+7+8+1)=11,所以W为Na元素,
A.同周期自左向右原子半径减小,同主族自上到下原子半径增大,故原子半径Na>C>N>O>H,即W>X>Y>Z>M,故A错误;
B.W2Z2为过氧化钠,为离子化合物,故B错误.
C.X为C,形成的单质由金刚石、石墨、C60等,只有石墨导电,故C正确;
D.由 X、Y、Z、M四种元素形成的化合物中,尿素只含有共价键,故D错误.
故答案选C
【思路点拨】本题考查了元素推断、元素周期律、分子结构、根据密度判断Y与M形成的气态化合物是氨气为推断的关键,


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
xA(g)+2B(s)yC(g) ΔH<0
在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)用A的浓度变化表示该反应0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。
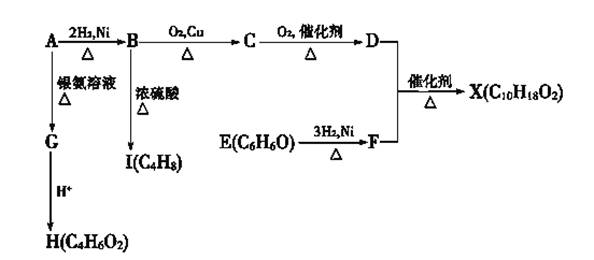
请根据上述信息回答:
(1)C的名称是 。B→I的反应类型为 。
(2)只用一种试剂鉴别D、E、H,该试剂是 。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为 。
(4)核磁共振氢谱图中D有 组峰且峰面积之比为 。
(5)D和F反应生成X的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA 为阿伏加德罗常数的值。下列说法正确的是 ( )
A.标准状况下,2.24 L 水中所含的电子数为NA
B.常温常压下,16 g O3所含的电子数为8NA
C.0.1 mol Na2O2 晶体中所含的离子数为0.4NA
D.1 mol Fe在氧气中充分燃烧失去的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为元素周期表中短周期的一部分,下列说法错误的是
| X | Y |
| Z | W |
A. W的原子序数可能是Y的两倍
B.单质的活泼性可能是Y>Z
C.气态氢化物的稳定性X<Y
D. Y 、W的最高价氧化物对应水化物可能均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项中,理由、结论及因果关系均正确的是 ( )
A.由于键能EN≡N> ECl-Cl,故单质的沸点:N2>Cl2
B.由于分子中可电离的H+个数H2SO4> CH3COOH,故两者的酸性:H2SO4>CH3COOH
C.由于元素的非金属性N>P,故氢化物的稳定性:NH3>PH3
D.由于金属性Fe>Cu, 故还原性Fe2+>Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为: Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac 。完成下列填空:
[Cu(NH3)3CO]Ac 。完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是 。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式_____________________
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为__________________。通过比较_____________________________可判断氮、磷两种非金属元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是_________________。CS2熔点高于CO2,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关下图所示化合物的说法不正确的是( )
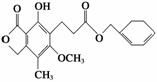
A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B.1 mol该化合物最多可以与3 mol NaOH反应
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知MgO、MgCl2的熔点分别为2800℃、604℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。海水中含有MgCl2,工业上从海水中提取镁,正确的方法是( )
A. 海水 Mg(OH)2
Mg(OH)2 Mg
Mg
B. 海水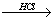 MgCl2溶液
MgCl2溶液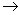 MgCl2熔融
MgCl2熔融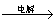 Mg
Mg
C. 海水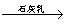 Mg(OH)2
Mg(OH)2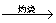 MgO
MgO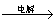 Mg
Mg
D.海水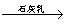 Mg(OH)2
Mg(OH)2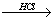 MgCl2溶液
MgCl2溶液  MgCl2熔融
MgCl2熔融 Mg
Mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com