
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氧化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是__________________,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离了方程式表示)___________________________。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。
①若酸性FeCl2溶液中c(Fe2+)=2.0×10-2mol/L,c(Fe3+)=1.0×10-3mol/L,c(Cl-)=5.3×10-2mol/L,则该溶液的pH约为________________。
②完成NaClO3氧化FeCl2的离子方程式:□ClO3-+□Fe2++□___=□Cl-+□Fe3++□____。
(3)FeCl3在溶液中分三步水解:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是________________________。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号)___________。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是_______________________。
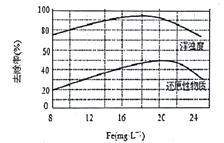
(4)天津某污水处理厂用氯化铁净化污水的结果如图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为_________mg·L-1。
【答案】 Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质 2Fe3++Fe=3Fe2+ 2 1 6 6H+ 1 6 3H2O K1>K2>K3 b d 调节溶液的pH 18~20
【解析】本题主要考查盐类水解的影响因素。
(1)FeCl3净水的原理是Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是2Fe3++Fe=3Fe2+。
(2)若酸性FeCl2以液中电荷守恒:2c(Fe2+)+3c(Fe3+)+ c(H+)=c(Cl-)+c(OH-),酸性溶液中可忽略c(OH-),c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-2mol/L,则该溶液的pH约为2。
②根据电子守恒初步将方程式配平为ClO3-+6Fe2++□___=Cl-+6Fe3++□____。再根据溶液呈酸性、电荷守恒和元素守恒得到完整方程式:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O。
(3)FeCl3的分步水解程度越来越小,所以K1>K2>K3。
欲使平衡正向移动可采用的方法是bd。a.盐类水解为吸热反应,降温平衡左移,故a不符合题意;b.加水稀释促进盐类水解,故b符合题意;c.NH4Cl 的水解抑制上述水解,故c不符合题意;d.NaHCO3的水解促进上述水解,故d符合题意。故选bd。
分析离子方程式:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+可知室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是调节溶液的pH。
Fex(OH)y(3x-y)++yH+可知室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是调节溶液的pH。
(4)由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为18~20mg·L-1。


科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
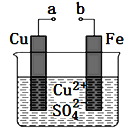
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b相连构成原电池,电子由a流向b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种高效清洁、极具发展潜力的能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
已知下列反应:
反应I:CH3CH2OH(g)+H2O(g) ![]() 2CO(g)+4H2(g) △H1
2CO(g)+4H2(g) △H1
反应Ⅱ:CO(g)+ H2O(g) ![]() CO2(g)+ H2(g) △H2
CO2(g)+ H2(g) △H2
反应Ⅲ:2 CO2(g)+ 6H2(g) ![]() CH3CH2OH(g)+3H2O(g) △H3
CH3CH2OH(g)+3H2O(g) △H3
反应Ⅳ:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g) △H4
CH2=CH2(g)+4H2O(g) △H4
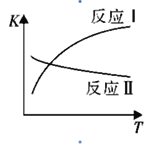
(1)反应I和反应II的平衡常数随温度变化曲线如图所示。则△H1 _________△H2(填“>”、“<”或“=”);△H3=_________(用△H1、△H2表示)。
(2)向2L密闭容器中充入H2和CO2共6mol,改变氢碳比[n(H2)/n(CO2)]在不同温度下发生反应III达到平衡状态,测得的实验数据如下表。分析表中数据回答下列问题:
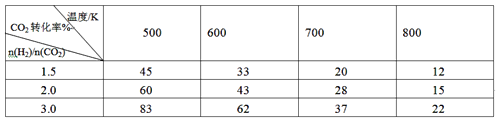
①温度升高,K值__________(填“增大”、“减小”、或“不变”)。
②提高氢碳比,K值____(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
③在700K、 氢碳比为1.5,若5min反应达到平衡状态,则0~5min用H2表示的速率为__________。
(3)反应III在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。
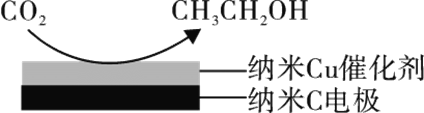
①阴极的电极反应式为________。
②从电解后溶液中分离出乙醇的操作方法为________。
(4)在一定条件下发生反应Ⅳ,测得不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,下列有关说法正确的为________(填序号)。
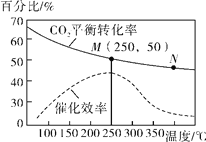
①不同条件下反应,N点的速率最大
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的平衡转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.00mol·L-1HCl溶液和V2mL未如浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )

A. 做该实验时环境温度为22℃ B. 该实验表明化学能可以转化为热能
C. NaOH溶液的浓度约为1.00mol·L-1 D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①海带等藻类物质经过处理后,可以得到碘水,向碘水中加入四氯化碳以提取碘单质的实验操作叫________,该操作需要的玻璃仪器有________。
②某NaCl样品中可能含有SO42-,CO32-,为检验杂质离子的存在,采取如下实验步骤:样品![]() 无明显现象
无明显现象![]() 无明显现象。则加入的试剂A为_______,B为_______,该现象证明样品中不含有____。
无明显现象。则加入的试剂A为_______,B为_______,该现象证明样品中不含有____。
③在后续实验中需要使用450mL0.5 mol·L- 1NaCl溶液,为配制该浓度NaCl溶液进行实验,需用托盘天平称取NaCl_______g。配制NaCl溶液时,若出现下列操作,会使配制浓度偏高的是(_____)
A.天平砝码己锈蚀 B.配制过程中未用蒸馏水洗涤烧杯和玻璃棒
C.转移溶液时有溶液溅出 D.定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从牛至精油中提取的三种活性成分的结构简式如下图所示,下列说法正确的是

A. a中含有2个手性碳原子(手性碳原子指连有四个不同基团的碳原子)
B. b分子存在属于芳香族化合物的同分异构体
C. c分子中所有碳原子可能处于同一平面
D. a、b、c均能发生加成反应、取代反应、加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是________,操作②的名称是____________。
(2)试剂a是____________(填化学式,下同),试剂b是__________,固体B是____________。
(3)加入试剂a所发生反应的化学方程式为__________________________________。
加入试剂b所发生反应的化学方程式为____________________________________。
(4)该方案能否达到实验目的:__________________________(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)__________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com