
【题目】课外学习小组为检验溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作。其中操作过程中产生的气体能使红色石蕊试纸变蓝,由该实验能得到的正确结论是( )
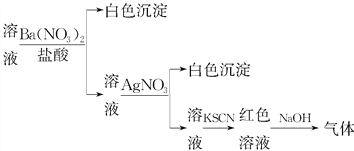
A. 溶液中一定含有SO![]()
B. 溶液中一定含有NH![]()
C. 溶液中一定含有Cl-
D. 溶液中一定含有Fe3+
【答案】B
【解析】在溶液中加入盐酸酸化的硝酸钡,其中的亚硫酸根离子、亚铁离子会被氧化为硫酸根离子、铁离子,加入的盐酸中含有氯离子,会和硝酸银反应生成氯化银白色沉淀,能使红色石蕊试纸变蓝的气体是氨气,三价铁离子能使硫氰酸钾变为红色。A、原溶液中加入盐酸酸化的硝酸钡,如果其中含有亚硫酸根离子,则会被氧化为硫酸根离子,所以原溶液中不一定含有SO42-离子,故A错误;B、产生能使红色石蕊试纸变蓝的气体是氨气,所以原来溶液中一定含有铵根离子,故B正确;C、原溶液中加入盐酸酸化的硝酸钡,引进了氯离子,能和硝酸银反应生成氯化银沉淀的离子不一定是原溶液中含有的氯离子,可能是加进去的盐酸中的,故C错误;D、原溶液中加入盐酸酸化的硝酸钡,如果其中含有亚铁离子,则亚铁离子会被氧化为铁离子,铁离子能使硫氰酸钾变为红色,所以原溶液中不一定含有Fe3+离子,故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使凹液面处于“0”刻度以下的位置,记下读数;
②将锥形瓶用蒸馏水洗净后,直接从碱式滴定管中放入20.00mL待测溶液到锥形瓶中;
③将酸式滴定管用蒸馏水洗净后,立即向其中注入0.2000mol/L标准稀硫酸溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;
④ 向锥形瓶中滴入几滴酚酞作指示剂,进行滴定,测出所耗硫酸的体积;
向锥形瓶中滴入几滴酚酞作指示剂,进行滴定,测出所耗硫酸的体积;
⑤重复以上过程。
试回答下列问题:
(1)当滴入最后一滴稀硫酸时,____________________,可判断达到滴定终点。
(2)滴定过程中,下列会导致滴定结果偏低的是( )
A、若记录读数时,起始时仰视,终点时俯视
B、滴定前向锥形瓶中加入10 mL蒸馏水,其余操作正常
C、若配制硫酸时,定容时俯视刻度,其他操作正常
D、酸式滴定管在装酸液前未用待测硫酸溶液润洗
E、开始实验时碱式滴定管尖嘴部分有气泡,滴定结束气泡消失
(3)测定操作中有一步存在问题,该步骤是:__________________(填序号)
(4)根据下列数据:
滴定次数 | 待测液体积(mL) | 标准硫酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.50 | 25.45 |
第二次 | 20.00 | 4.00 | 29.05 |
第三次 | 20.00 | 3.00 | 30.00 |
第四次 | 20.00 | 2.00 | 27.00 |
请计算待测烧碱溶液的浓度为 mol/L。
(5)为了测定产品中(NH4)2Cr2O7的含量,称取样品0.150 0 g,置于锥形瓶中,加50 mL水,再加入2 g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10 min,加入3 mL 0.5%淀粉溶液并稀释成250ml溶液,取25ml该溶液,用0.010 0 mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00 mL,则上述产品中(NH4)2Cr2O7的纯度为 。(假定杂质不参加反应,已知:①Cr2O72-+6I-+14H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4种相邻的主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。回答下列问题:
m | n | ||
x | y |
(1)元素x在周期表中的位置是第_____周期、第____族,其单质可采用电解熔融的_____方法制备。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是______,碱性最强的是______.(填化学式)
(3)气体分子(mn)2的电子式为_______,(mn)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质X与浓H2SO4共热,反应中X与浓H2SO4的物质的量之比为1:2,则X元素在生成物中的化合价可能为 ①+l ②+2 ③+3 ④+4
A. ②④ B. ③④ C. ①② D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关丙烷和戊烷的叙述不正确的是( )
A.分子中碳原子不在一条直线上
B.戊烷有三种同分异构体
C.丙烷比丁烷更易液化
D.新戊烷的沸点比正戊烷的沸点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的容器中加入1.5mol氙气(Xe)和7.5mol氟气(F2),于400℃和2633kPa压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5mol氟气,则所得无色晶体产物中,氙与氟的原子个数之比是
A.1∶2 B.1∶3 C.1∶4 D.1∶6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com