
| A. | 一氧化碳的转化率提高,水蒸气的转化率降低 | |
| B. | 反应物的转化率都提高 | |
| C. | 平衡向正反应方向移动,达到新的平衡时二氧化碳的体积分数增大 | |
| D. | 平衡向正反应方向移动,二氧化碳的物质的量将大于1 mol但小于2 mol |
分析 反应CO(g)+H2O(g)?CO2(g)+H2(g),达平衡后,加入水蒸气,化学平衡会向着正反应方向进行,但是反应物不可能全部转化为生成物,依此分析.
解答 解:根据题意:CO+H2O(g)?CO2 +H2,
初始物质的量:1 1 0 0
变化物质的量:0.6 0.6 0.6 0.6
平衡物质的量:0.4 0.4 0.6 0.6
此时二氧化碳和氢气的物质的量之和是1.2mol,平衡状态二氧化碳体积分数=$\frac{0.6mol}{0.4mol+0.4mmol+0.6mol+0.6mol}$×100%=30%,再通入2mol水蒸气,化学平衡会向着正反应方向进行,假设一氧化碳全部转化完毕,则会生成二氧化碳和氢气各0.4mol,此时CO2的物质的量1mol,但是一氧化碳不会全部转化,所以达到新的平衡后,CO2的物质的量介于0.6mol-1mol之间,加入的水蒸气2mol 不能全部转化生成的二氧化碳;
A、加入2mol水蒸气,平衡向正反应方向移动,一氧化碳转化率增大,水的转化率减小,故A正确;
B、加入2mol水蒸气,平衡向正反应方向移动,一氧化碳转化率增大,水的转化率减小,故B错误;
C、加入2mmol水蒸气,平衡向正反应方向移动,达到新的平衡时二氧化碳的体积分数减小,故C错误;
D、平衡向正反应方向移动,但是一氧化碳不会全部转化,所以达到新的平衡后,CO2的物质的量介于0.6mol-1mol之间,故D错误;
故选A.
点评 本题考查了化学平衡影响因素分析判断,题目难度中等,注意反应可逆反应特点之一是不能进行彻底,掌握可逆反应的特点和平衡移动是关键.


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H20+SO2═2NH4++SO32-+H2O | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+═2Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
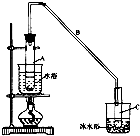 环己烯是一种重要的化工原料.
环己烯是一种重要的化工原料. .
.| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11 | |
| B. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| C. | 分别加水稀释10倍、四种溶液的pH:①>②>③>④ | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c (NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com