
【题目】某研究性学习小组设计了用氧化浓盐酸的方法制取氯气的实验,其实验装置如下图:
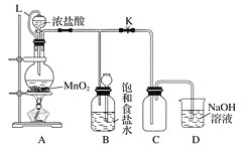
(1)写出圆底烧瓶中发生反应的化学方程式:___________________________________。
(2)如果将过量的二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要的原因有①______________________;②_________________。
(3)L的作用是____________________;B的作用是_________________。
(4)为了提高浓盐酸的利用率,你对实验的建议是____________。
【答案】MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑ 反应中HCl消耗,盐酸变稀,稀盐酸不能与MnO2反应 加热中有部分HCl挥发而损失 恒压条件下确保浓盐酸能顺利滴加 利用氯气在饱和食盐水中溶解度很小的性质而贮存氯气 将浓盐酸慢慢滴下;加热时用小火慢慢加热等
MnCl2+2H2O+Cl2↑ 反应中HCl消耗,盐酸变稀,稀盐酸不能与MnO2反应 加热中有部分HCl挥发而损失 恒压条件下确保浓盐酸能顺利滴加 利用氯气在饱和食盐水中溶解度很小的性质而贮存氯气 将浓盐酸慢慢滴下;加热时用小火慢慢加热等
【解析】
1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应,随着反应的进行,盐酸的浓度逐渐减小,浓盐酸易挥发;
(3)L将分液漏斗与圆底烧瓶连接,起到平衡压强作用;浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水;
(4)依据浓盐酸易挥发性,控制浓盐酸的用量。
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,答案为:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑;
MnCl2+2H2O+Cl2↑;
(2)盐酸具有挥发性,加热促进氯化氢的挥发,随着反应的进行,盐酸的浓度逐渐减小,二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应,答案为:反应中HCl消耗,盐酸变稀,稀盐酸不能与MnO2反应;加热中有部分HCl挥发而损失;
(3)L将分液漏斗与圆底烧瓶连接,起到平衡压强作用,便于液体顺利流下;浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以用饱和食盐水吸收氯气中的氯化氢;答案为:恒压条件下确保浓盐酸能顺利滴加;利用氯气在饱和食盐水中溶解度很小的性质而贮存氯气;
(4)因为浓盐酸易挥发,为了提高浓盐酸的利用率,应小火加热,答案为:将浓盐酸慢慢滴下;加热时用小火慢慢加热等。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )

A.该反应的化学方程式为3B+4D6A+2C
B.反应进行到1s时,v(A)=v(C)
C.反应进行到6s时,B和D的物质的量浓度均为0.4molL﹣1
D.反应进行到6s时,B的平均反应速率为0.05mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解含ClO2的NaCl溶液可以获得消毒剂NaClO2,该工艺尾气吸收时的反应为2ClO2 + 2NaOH + H2O2 = 2NaClO2 + O2 + 2H2O。下列有关说法正确的是

A.电解时,化学能会转化为电能和热能
B.电解时,ClO2转化为ClO的反应发生在阳极
C.尾气吸收生成11.2 L O2时,H2O2失去1 mol电子
D.2H2O2(aq)=2H2O(l) + O2(g) ΔH<0过程中的能量变化如图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知稀硝酸和铜能发生反应,生成硝酸铜、一氧化氮气体和水。
(1)请写出该反应的化学方程式,并用双线桥法标出反应中电子转移的方向和数目。________
(2)一次实验中,某同学用过量的稀硝酸(其密度为1.08 g·mL-1,HNO3的质量分数为12%)跟一定量的铜片反应,产生了标准状况下0.56 L的一氧化氮。试计算(简要写出计算过程):
①该稀硝酸的物质的量浓度(结果保留小数点后一位);______________
②被还原的HNO3的物质的量。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铁[Fe2(OH)nCl6-n]m简称PFC,是一种新型高效的无机高分子净水剂。以FeCl2·4H2O为原料,溶于稀盐酸并加入少量的NaNO2,经氧化、水解、聚合等步骤,可制备PFC。
(1)在稀盐酸中,NaNO2会与Fe2+反应生成一种无色气体M,气体M对该反应有催化作用,其催化原理如图所示。 M的化学式为______; Fe2+在酸性条件下被O2氧化的离子方程式为_______。

(2)盐基度[B=![]() × 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响______。(填“越大”、“越小”或“无影响”)
× 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响______。(填“越大”、“越小”或“无影响”)
(3)PFC样品中盐基度(B)的测定:
已知:PFC样品的密度ρ = 1.40 g·mL1,样品中铁的质量分数ω(Fe) = 16%
步骤1:准确量取1.00 mL PFC样品置于锥形瓶中。
步骤2:加入一定体积0.05000 mol·L1的盐酸标准溶液,室温静置后,加入一定体积的氟化钾溶液(与Fe3+反应,消除Fe3+对实验的干扰),滴加数滴酚酞作指示剂,立即用0.05000 mol·L1氢氧化钠标准溶液滴定至终点,消耗氢氧化钠标准溶液13.00 mL。
步骤3:准确量取1.00 mL蒸馏水样品置于锥形瓶中,重复步骤2操作,消耗氢氧化钠标准溶液49.00 mL。
根据以上实验数据计算PFC样品的盐基度(B)(写出计算过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种不溶于水的固体。A是某元素的一种单质,它在氧气中完全燃烧得到一种无色气体,此气体能使澄清石灰水变浑浊,另外测得这种气体密度为同温、同压下氧气密度的1.375倍。B固体能溶于热氢氧化钠溶液,再往所得溶液中加入过量盐酸时,析出白色胶状沉淀D。此沉淀干燥后,成为不溶于水的白色粉末,这是一种比碳酸酸性还弱的酸。将B与石灰石、纯碱按比例混合加热得到C,C在高温时软化,无固定熔点。
(1)根据以上事实,形成单质A的元素名称为__, C的名称为__。
(2)B固体溶于热氢氧化钠溶液的化学方程式是__。
(3)生成白色胶状沉淀D的化学方程式是__。
(4)由B制取C的化学方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g)+B(g)![]() C(g)+D(g)的平衡常数和温度的关系如下:
C(g)+D(g)的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
现有两个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molA和1molB,在Ⅱ中充入1molC和1 molD,800℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中的压强相等B.容器Ⅰ、Ⅱ中反应的平衡常数相同
C.容器Ⅰ中C的体积分数比容器Ⅱ中的小D.容器Ⅰ中A的浓度比容器Ⅱ中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
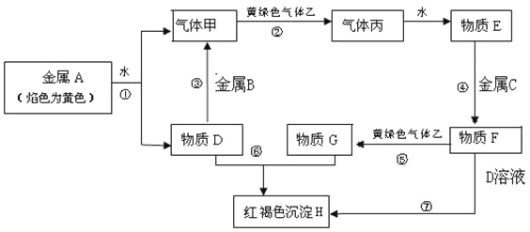
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A_______、F________、H________。
(2)反应过程⑦可能观察到的实验现象______,反应的化学方程式为④_________。
(3)反应⑤的离子方程式为__________。
(4)反应①-⑦的7个反应属于氧化还原反应反应的有 ________(填选项代号)。
A.①②④⑤⑥ B.②③④⑥⑦ C.①②③④⑤⑦ D.全部
(5)向纯碱溶液中通入气体乙,可制得某种生产生活中常用的漂白、消毒的物质,同时有小苏打生成。该反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)2HI(g)△H=-akJ/mol,已知: (a、b、c均大于零)
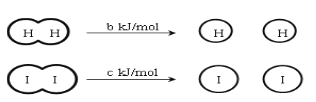
下列说法正确的是
A.碰撞理论认为,反应速率的大小与单位时间内反应物微粒间碰撞次数成正比,只要有足够的能量就可以发生有效碰撞
B.断开2molHI分子中的化学键所需能量约为(c+b+a)kJ
C.相同条件下,1molH2(g)和1molI2(g)总能量小于2molHI(g)的总能量
D.向密闭容器中加入2molH2(g)和2molI2(g),充分反应后放出的热量为2akJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com